Modalité de prélèvement
On prélève les liquides d’épanchement en respectant scrupuleusement les règles d’asepsie et idéalement avant toute antibiothérapie.
Le prélèvement se fait par ponction. On le recueille dans trois flacons stériles dont un contient du citrate de sodium comme anticoagulant.
Ce sont des liquides précieux pour lesquels l’analyse est urgente.
Distinguer un exsudat d’un transsudat
Les critères utilisés pour cette distinction varient selon les liquides, les plus pertinents sont présentés dans le tableau 7.
Tableau 7 : Critères pour différencier exsudat de transudat
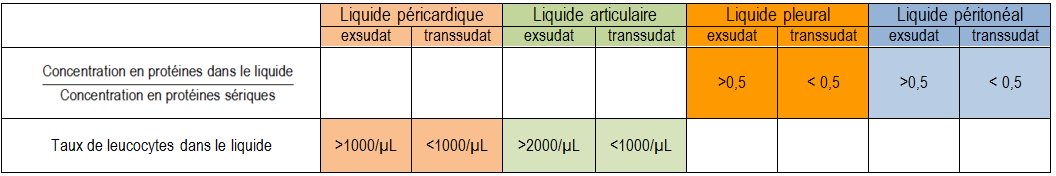
Seuls les exsudats intéressent le laboratoire de microbiologie, les transsudats n’étant pas d’origine infectieuse.
Examen macroscopique
Il faut noter sa couleur, sa limpidité et sa viscosité.
L’aspect macroscopique peut aider à distinguer un exsudat d’un transsudat mais, à lui seul, ce critère n’est pas suffisamment performant.
Cependant l’examen macroscopique peut être utile à l’orientation diagnostique. Ainsi :
- un liquide articulaire ou péricardique trouble est presque toujours un exsudat
- un liquide pleural ou péritonéal trouble peut être un transsudat
- si un exsudat (confirmé par des paramètres cellulaires et/ou biochimique) est clair, il faut penser à une infection tuberculeuse ou une infection virale.
Examen microscopique
Dénombrement des hématies et des leucocytes en hématimètre
Comme indiqué précédemment, lorsqu’il s’agit de liquide articulaire ou péricardique, le taux de leucocytes est un bon critère pour différencier transsudat et exsudat (<1000 leucocytes/µL pour un transsudat).
En outre, il permet de poser le diagnostic d’infection bactérienne. En effet, dans ce cas, le taux de leucocytes dans le liquide d’épanchement est très élevé. Voici quelques chiffres pour l’illustrer :
- 80 % des arthrites bactériennes présentent plus de 20 000 leucocytes/µL
- 95% des pleurésies bactériennes présentent plus de 10 000 leucocytes/µL
- 80% des péricardites présentent plus de 5 000 leucocytes/µL
Préparation des lames
On prépare les lames par cytocentrifugation ou en réalisant des frottis à partir d’un culot de centrifugation à 3000 tours/min pendant 10 minutes.
Elles sont colorés au MGG, au Gram et éventuellement à l’auramine (si liquide clair et lymphocytaire).
La formule leucocytaire sur frottis coloré au MGG
On l’effectue lorsque la concentration en leucocytes est supérieure à 1000/µL.
L’examen des résultats obtenus est susceptible d’influencer sensiblement la suite de l’analyse. Parmi ces résultats, trois types de formules cytologiques sont particulièrement évocateurs.
Prédominance de granulocytes neutrophiles
C’est le cas pour la majeure partie des épanchements inflammatoires, qu’ils soient d’origine infectieuse ou pas.
La présence de granulocytes neutrophiles altérés oriente vers une infection bactérienne.
Prédominance de lymphocytes
Elle est beaucoup plus fréquente dans un liquide clair que dans un liquide purulent.
Une telle formule doit faire penser à une infection tuberculeuse ou virale. Dans ce cas, il faut faire une coloration à l’auramine après cytocentrifugation, puis ensemencer des milieux adaptés aux mycobactéries.
Granulocytes éosinophiles > 10%
Pour un liquide articulaire, on peut envisager une arthrite parasitaire (filariose).
Pour un liquide pleural, les principales causes sont un hémothorax1 ou un pneumothorax2.
1 hémothorax = épanchement de sang dans la cavité pleurale
2 pneumothorax =épanchement d’air dans la cavité pleurale
Examen direct après coloration de Gram
En règle générale, l’examen direct est positif lors de pleurésies bactériennes et dans 50 à 75% des cas d’arthrites infectieuses.
En revanche, il est positif seulement dans 10% des cas d’infection du liquide d’ascite.
L’observation de bactéries est d’un intérêt primordial pour orienter le diagnostic. En effet, les infections des séreuses sont presque toujours monomicrobiennes (mises à part les péritonites et certaines pleurésies).
Cas particuliers des liquides articulaires
Le diagnostic des arthrites microcristallines se fait par l’observation d’un frottis coloré au MGG en lumière polarisée, éventuellement complétée par un état frais.
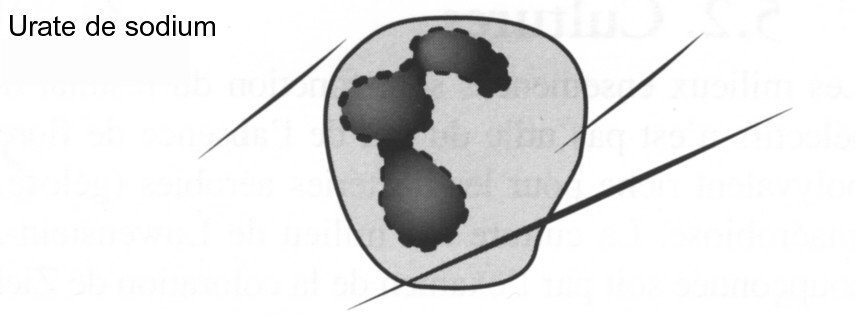
Les cristaux d’urate de sodium
Ils sont présents lors de la crise de goutte.
- en forme d’aiguilles fines
- en moyenne de 10 à 20 µm
- très réfringents
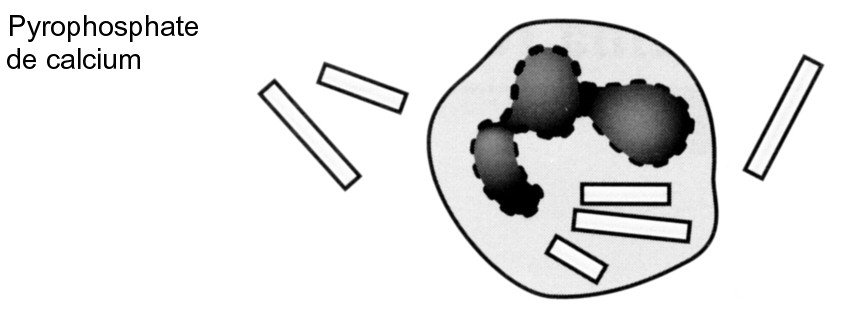
Les cristaux de pyrophosphate de calcium
Ils sont présents lors de chondrocalcinose calcique.
- en forme de parallélépipède, de rectangle, de carré et de losange à bouts arrondis
- en moyenne de 5 à 10 µm
- intra ou extra cellulaires
- non ou très peu réfringents
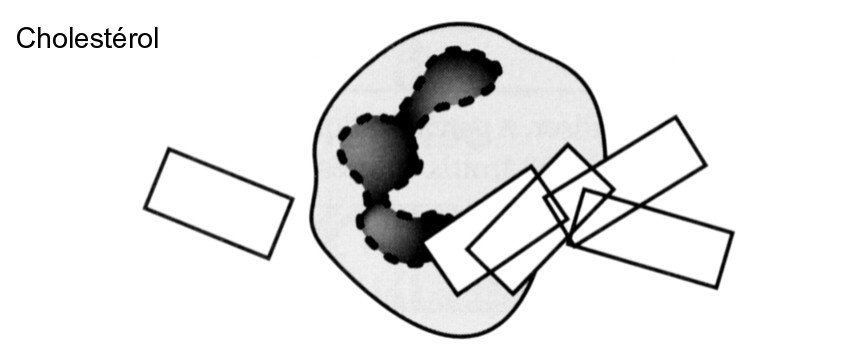
Les cristaux de cholestérol
Ils peuvent être observés au cours de la polyarthrite rhumatoïde.
- En forme de rectangle
- En moyenne 10 à 20 µm
Mise en culture
On réalise des isolement sur les milieux suivants :
- gélose chocolat enrichie incubée en atmosphère enrichie en CO2 ;
- gélose au sang incubée en aérobiose
- gélose au sang incubée en anaérobiose
Lors de prélèvement monomicrobien, l’ensemencement de milieux sélectifs ne se justifie pas.
À l’inverse, lors de prélèvement plurimicrobien, il faut ensemencer en supplément des milieux d’isolement sélectifs.
On ensemence ces milieux par étalement de 3 à 4 gouttes du liquide d’épanchement sur la moitié de la boite. Le reste de la boite est ensuite ensemencé par épuisement. L’ensemencement peut être moins abondant si l’examen direct montre que le liquide est riche en germes.
Il est recommandé d’ensemencer systématiquement, avec le liquide d’épanchement, des flacons d’hémocultures afin d’améliorer la sensibilité des cultures, notamment lorsque le sujet est sous traitement antibiotique avant la ponction. En l’absence de flacon d’hémoculture, il faut ensemencer un bouillon Schaedler + vitamine K3 ou un milieu de Rosenow.
Enfin si le liquide est clair et lymphocytaire, il faut ensemencer des milieux convenant aux mycobactéries.
Ces milieux seront incubés à 35°C pendant un minimum de 7 jours.
Notons que, pour gagner du temps, on peut tenter de réaliser l’antibiogramme, le premier jour de l’analyse, directement à partir du liquide d’épanchement.