Contextes
Les principaux objectifs de l’analyse des prélèvements pharyngés au laboratoire de bactériologie dépendent du contexte (Tableau 3).
Tableau 3 : Principaux objectifs de l’analyse des prélèvements pharyngés

Modalité de prélèvement et de transport
Prélèvement
Le prélèvement se fait de préférence avant toute antibiothérapie locale ou générale.
On utilise un abaisse-langue pour éviter tout contact salivaire.
On le recueille de préférence sur deux écouvillons (un pour effectuer les frottis, l’autre pour la mise en culture)
Le site du prélèvement dépend du contexte :
- le plus souvent au niveau des amygdales ;
- s’il existe un exsudat, à son niveau ;
- s’il existe des fausses membranes, à leur périphérie ;
- pour la recherche de Candida spp., le prélèvement s’effectue au niveau de la langue, du palais et de la face interne des joues.
Transport
Un milieu de transport type Stuart ou Amies doit être utilisé dans les cas suivants :
- recherche de Neisseria gonorrhoeae si la mise en culture n’est pas immédiate ;
- recherche des autres germes si le délai avant la mise en culture est supérieur à deux heures.
Examen microscopique
Son intérêt est souvent limité en raison de l’abondance de la flore commensale.
Cependant cet examen microscopique est capital dans les cas suivants :
- l’observation d’une flore de bacilles fusiformes (Fusobacterium) et de spirochètes (Borrelia vincentii) tous les deux Gram – suffit au diagnostic de l’angine de Vincent ;
- l’observation de spores ou filaments mycéliens oriente vers une mycose à Candida albicans.
- l’observation de nombreux coques à Gram positif, formant de longues chaînettes, associés à de nombreux granulocytes neutrophiles oriente vers une angine à streptocoque A, C ou G.
Mise en culture
Technique d’isolement
Il existe deux techniques d’isolement :
- on presse l’écouvillon dans un petit volume de bouillon de transport puis on dépose une goutte de bouillon à la surface des boites. L’isolement se fait ensuite avec un ensemenceur.
- on ensemence directement à l’écouvillon le premier cadran des milieux de culture puis la suite de l’isolement se fait avec un ensemenceur.
Choix des milieux
On ensemence systématiquement des milieux non sélectifs et suffisamment riches pour assurer le développement des germes exigeants : une gélose au sang frais et une gélose chocolat + polyvitex.
Puis on incube ces 2 milieux 24 à 48 heures sous .
Des milieux sélectifs sont ensuite choisis en fonction du contexte et des résultats de l’observation microscopique.
Recherche des Streptocoques A, C et G
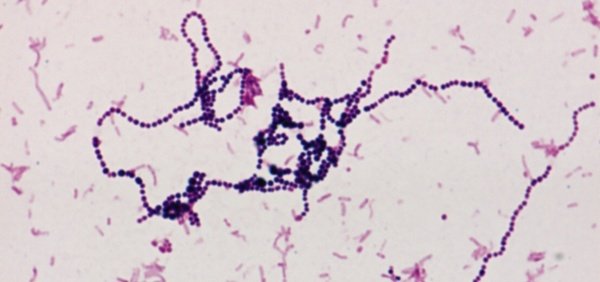
Un examen microscopique évocateur montrera de nombreux coques à Gram positifs groupés en chaînettes plus ou moins longues et de nombreux granulocytes.(Fig 11).
© Pascal Fraperie
Il faut ensemencer une gélose au sang + ANC (milieu sélectif des bactéries Gram +) incubée sous 5 à 10% de C02 pendant 24 à 48 h. Notons que le caractère ß hémolytique est encore plus net, si on incube la gélose en anaérobiose.
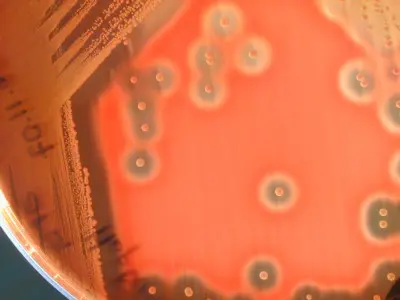
Les colonies suspectes apparaissent ß hémolytiques (Fig.12)
L’hémolyse ß est une hémolyse à bords nets et complète (zone transparente).
Fig.12 : Colonie de streptocoque A sur gélose au sang frais
© Pascal Fraperie
L’examen microscopique montre des coques à Gram positifs habituellement ronds et formant des chaînettes. Notons que les chaînettes des Streptococcus sont plus courtes quand on prépare le frottis à partir d’une colonie.
Ensuite, après avoir vérifié l’absence de catalase, on réalise un groupage antigénique après extraction enzymatique (Fig.13).
On peut aussi identifier cette espèce par spectromètrie de masse Maldi-Tof.
© Pascal Fraperie
L’antibiogramme par la méthode des disques se fait sur une gélose MH-F incubée sous 5 à 10% de C02.
Recherche d’Arcanobacterium haemolyticum
Cette recherche se justifie particulièrement lorsque l’angine s’accompagne d’un rash cutané.
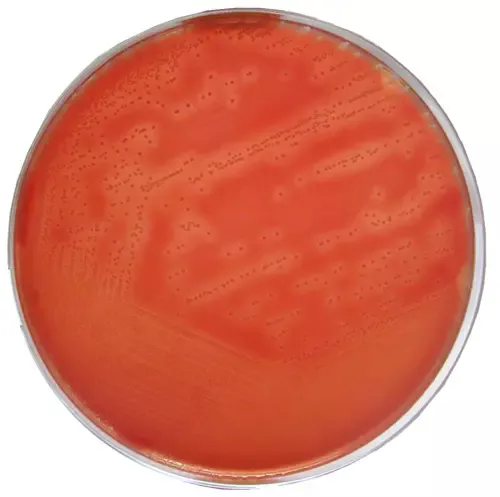
Il faut ensemencer une gélose au sang + ANC incubée sous 5 à 10% de CO2 pendant 4 jours.
Les colonies sont petites en 24h, grises, translucides et entourées d’une fine zone d’hémolyse ß (Fig.14). L’hémolyse est plus nette après 48h.
L’examen microscopique montre des bacilles Gram positif irréguliers, courts et légèrement branchés (Fig.15).
Le genre Arcanobacterium se distingue des autres bactéries corynéformes par un test catalase -. L’identification d’Arcanobacterium haemolyticum est possible avec une galerie API Coryne®.
sur gélose au sang (24 h à 37°C en atmosphère enrichie en CO2)
© Pascal Fraperie

Recherche de Corynebacterium du complexe diphtheriae
Si le sujet présente les signes cliniques de la diphtérie (voir la page Diphtérie), il s’agit d’un diagnostic d’urgence et les résultats doivent être communiqués au fur et à mesure. Des examens permettent de donner successivement un diagnostic de présomption, un diagnostic de probabilité et un diagnostic de certitude.
Le diagnostic de certitude correspond à la mise en évidence d’une souche toxinogène du complexe diphtheriae.
Prélèvement
On prélève à l’écouvillon (à la périphérie de la fausse membrane) ou bien à la pince (on essaie d’en détacher une partie, la fausse membrane est très adhérente à la muqueuse).
Examen microscopique du prélèvement
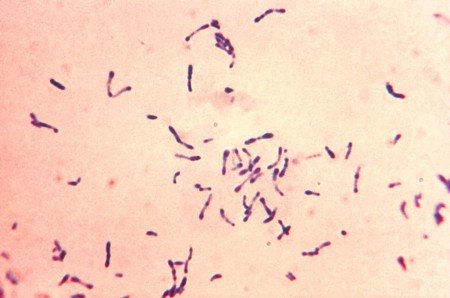
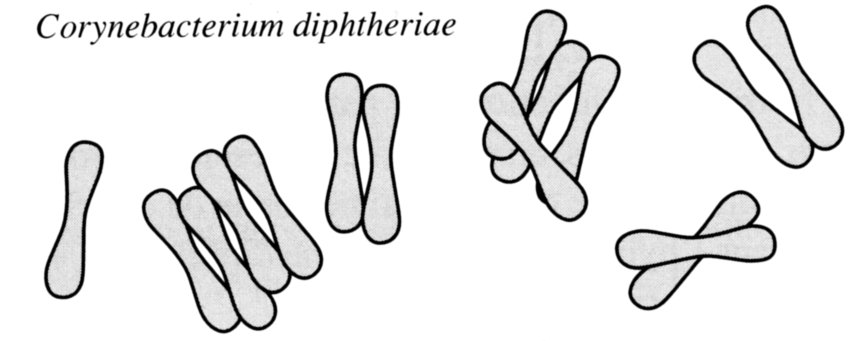
On recherche la présence de formes bactériennes évoquant le bacille diphtérique. C’est à dire des bacilles droits ou légèrement incurvés avec des extrémités arrondies ou renflées (aspect en massue en en haltère) présentant des arrangements en lettres, en paquets d’épingles et en palissade (Fig.16 et 17)
Il est rare que cet examen permette de conclure, car :
- dans l’hypothèse d’une angine diphtérique, le germe est peu abondant aussi bien dans le prélèvement que dans la fausse membrane ;
- en outre, il est difficile à l’examen microscopique de différencier Corynebacterium diphtheriae de certaines corynébactéries commensales de l’oropharynx.
| Le principal intérêt de l’examen microscopique est de s’assurer que l’angine pseudomembraneuse n’est pas un début d’angine de Vincent (on observera alors de nombreux bacilles fusiformes associés à de nombreux spirochètes) |
Le diagnostic de présomption est prononcé si de nombreux bacilles à Gram positif corynéformes sont observés.
CC by Centers for Disease Control and Prevention via Wikimedia Commons
Guy Leyral © CRDP d’Aquitaine
Mise en culture et repérage des colonies suspectes
En supplément de la gélose au sang, systématiquement ensemencée avec un prélèvement pharyngé, il convient d’ensemencer les géloses suivantes :
- Tinsdale
- gélose au sang + ANC
Gélose Tinsdale
C’est un milieu d’isolement sélectif permettant un très bon repérage des Corynebacterium du complexe diphtheriae.
En général, on prépare ce milieu juste avant son emploi car sa conservation se limite à une semaine.
Sur ce milieu, les Corynebacterium du complexe diphtheriae donnent des colonies noires (réduction du tellurite en tellure) entourées d’un halo brun (production d’H2S à partir de la cystine mis en évidence par un sel de fer III) (Fig.18)
Une coloration de Gram permet de s’assurer que ce sont bien des bactéries corynéformes. Leur aspect microscopique n’est cependant pas toujours caractéristique : les bacilles sont souvent plus courts et les arrangements si caractéristiques sont rares.

© CNR des corynebactéries du complexe diphtheriae, Institut Pasteur
Gélose au sang + ANC
Ce milieu est utile car il permet de récupérer certaines souches de bacilles diphtériques incapables de cultiver sur milieu de Tinsdale mais comme il est moins performant pour repérer les Corynebacterium du complexe diphtheriae, il ne peut se substituer à ce dernier.
Pour augmenter son pouvoir sélectif, on peut déposer un disque de fosfomycine dans le premier quadrant (les corynébactéries sont hautement résistantes à cet antibiotique).
Il est incubé 48h à 37°C sous 5 % de CO2.
Il faut accorder un intérêt tout particulier aux colonies présentes à proximité du disque de fosfomycine.
Identification biochimique des colonies suspectes
L’objectif est d’identifier les trois espèces du complexe diphtheriae ainsi que les trois biotypes de C. diphtheriae (gravis, mitis et belfanti ; le biotype intermedius ne semble plus être rencontré depuis plusieurs décennies).
Cette identification peut se faire par exemple par spectromètrie de masse Maldi-Tof ou en utilisant une galerie API Coryne®.
Si la souche identifiée appartient aux espèces C. diphtheriae, C. ulcerans ou C. pseudotuberculosis le diagnostic de probabilité est prononcé.
On envoit alors la souche d’urgence au Centre national de référence (CNR) des corynébactéries toxinogènes à l’Institut Pasteur à Paris, ce dernier vérifiera l’identification et recherchera son pouvoir toxinogène.
Détermination du pouvoir toxinogène
Pour commencer, on recherche le gène tox codant pour la toxine diphtérique par amplification génique (PCR). Ensuite on vérifie que les souches tox + sont capables de produire la toxine par un test d’immunoprécipitation en milieu gélosé : le test d’Elek.
Les souches présentant le gène tox mais un test d’Elek négatif sont cependant considérées comme toxinogènes.
Le diagnostic de certitude est prononcé si la souche est toxinogène. La déclaration est obligatoire. Le formulaire est téléchargeable sur internet.
Recherche de Candida albicans
Candida albicans est une levure. Elle est responsable du muguet.
Le diagnostic bactériologique est évident à l’examen direct : présence de spores ou de filaments mycéliens.
Pour isoler la levure, on peut ensemencer les milieux suivants :
- sur milieu Sabouraud + chloramphénicol ;
- sur milieu sélectif chromogène type Candiselect® de Biorad ou ChromID Candida® de bioMérieux.
Recherche de Neisseria gonorrhoeae
Il faut ensemencer les milieux juste après le prélèvement.
On ensemence une gélose chocolat enrichie sélective comme la gélose chocolat + polyvitex + VCAT (Vancomycine, Colistine, Amphotéricine B et Triméthoprime) et on l’incube sous 5 à 10% de C02 pendant au moins 48 heures.
Seules Neisseria meningitidis, Neisseria gonorrhoeae et un petit nombre d’espèce de Neisseria commensales cultivent sur ce milieu.
Les colonies de Neisseria gonorrhoeae sont petites, grisâtres avec des bords irréguliers.