Le choix de la méthode de prélèvement des sécrétions bronchopulmonaires est capital. Elle doit permettre de limiter au maximum des contaminations par des germes présents au niveau des voies aériennes supérieures et recueillir des sécrétions provenant bien du foyer infectieux.
Les caractéristiques des principaux types de prélèvement sont présentées tableau 4.
Expectoration (crachat) : ECBC
L’ECBC signifie examen cytobactériologique du crachat.
Comme cette technique de prélèvement est très pratique, on continue à l’utiliser. Mais beaucoup la critique. En effet, les flores commensales des voies aériennes supérieures contaminent le prélèvement. Ses partisans la recommandent à condition de prendre certaines précautions au moment du recueil.
Les précautions pour son recueil sont les suivantes :
- recueil dans un récipient stérile ;
- de préférence le matin à jeun ;
- après un rinçage bucco-dentaire à l’eau
- lors d’un effort de toux, aidé si besoin d’une kinésithérapie.
L’idéal est de le pratiquer avant toute antibiothérapie.
Avant la mise en culture, il faut s’assurer, grâce à un examen microscopique, que les flores commensales des voies aériennes supérieurs n’ont pas trop souillé le prélèvement (les cellules épithéliales oropharyngées sont les témoins de cette contamination).
Aspiration bronchique et l’aspiration endotrachéale (AET)
Leur objectif est de désencombrer les patients des sécrétions bronchiques afin de faciliter leur ventilation. On les pratique à l’aveugle (sans fibroscope) sauf pour certaines aspirations bronchiques réalisées à l’occasion d’une fibroscopie.
L’aspiration endotrachéale concerne seulement les sujets intubés, le recueil des sécrétions se faisant par la sonde d’intubation.
Pour ces deux modalités de prélèvements, le risque de contamination par la flore des voies aériennes supérieures est important.
Brossage bronchique protégé (BBP)
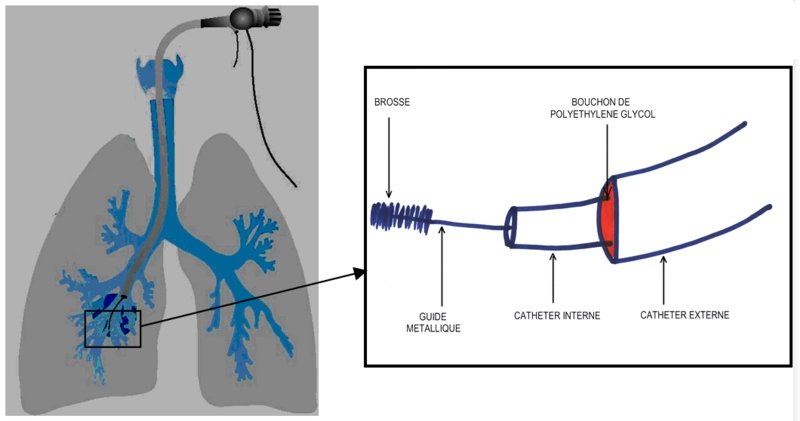
La référence demeure le dispositif de Wimberley (Fig.7) constitué d’une brosse en polyamide fixée à l’extrémité d’un guide métallique. Brosse et guide coulissent à l’intérieur d’un premier cathéter, lui même placé à l’intérieur d’un second cathéter, obturé par un bouchon de polyéthylène glycol. On glisse cette brosse télescopique au travers d’un fibroscope et on la dirige sous contrôle visuel dans une petite bronche de 4ème ordre drainant le territoire pulmonaire radiologiquement suspect. On pousse alors le cathéter interne. Il expulse le bouchon et permet d’avancer la brosse de quelques centimètres afin de réaliser le prélèvement bactériologique protégé.
Ensuite, on effectue les manœuvres inverses. Une fois le dispositif retiré de l’arbre bronchique, on désinfecte la partie externe du cathéter interne par de l’éthanol à 90%. Puis on fait sortir la brosse interne et on la coupe avec des ciseaux stériles pour qu’elle tombe dans 1 mL d’eau physiologique tamponnée stérile. Aussitôt, on agite l’ensemble (agitation mécanique de type vortex®) pendant 2 min environ. Le prélèvement est apporté sans délai au laboratoire.
Il faut d’emblée remarquer que l’échantillon prélevé ne représente qu’une faible quantité de sécrétions respiratoires (0,8 à 1 µL) diluée dans 1 mL d’eau physiologique.
Après avoir prélevé la quantité nécessaire pour la culture, on réalise une coloration de Gram sur le culot de centrifugation ou après cytocentrifugation.
Figure 7 : Dispositif de Wimberley
Aspiration bronchique distale protégée
Cette méthode s’appelle également, méthode du « cathéter distal protégé » ou « prélèvement distal protégé ».
L’introduction d’un double cathéter protégé par la sonde d’intubation se fait à l’aveugle. Si le patient n’est pas intubé, le prélèvement peut être guidé par un fibroscope.
Après avoir retiré le dispositif, le préleveur essuie le cathéter externe avec une compresse stérile imbibée d’alcool. Ensuite il fait ressortir de quelques centimètres le cathéter interne et le coupe avec des ciseaux stériles. Enfin il fait passer dans la lumière du cathéter 1 mL de sérum physiologique qu’il recueille dans un tube. Pour terminer, il sectionne le cathéter et place son extrémité distale dans le tube de recueil. Il agite ensuite le tube pendant 2 minutes.
Lavage bronchoalvéolaire (LBA)
Ce prélèvement, réalisé sous fibroscope, consiste à injecter une solution (50 à 250 mL) de liquide physiologique stérile à 37°C dans une bronche de 3° ou de 4° génération. On aspire ensuite une fraction de 20 à 60% du liquide injecté. Le LBA permet de récupérer les germes présents dans les bronchioles distales et les alvéoles pulmonaires.
Ainsi, l’avantage du LBA est d’explorer un plus vaste territoire pulmonaire alvéolaire avec le recueil d’une plus grande quantité de sécrétions. Cette méthode de prélèvement est particulièrement utile pour le diagnostic des pneumopathies observées chez les immunodéprimés et permet de rechercher des bactéries (Nocardia spp., Legionella spp., mycobactéries, Mycoplasma. pneumoniae, Actinomyces spp.) mais également des virus (Cytomegalovirus, Herpès), des champignons (Aspergillus spp., Cryptococcus spp., Candida spp., Pneumocystis jirovecii).
Le LBA n’est pas un prélèvement protégé. La flore des voies aériennes supérieures le contamine légèrement. L’observation de rares cellules épithéliales pharyngées témoignera de cette légère contamination.
Mini LBA
On le réalise à l’aide d’un double cathéter stérile et obturé par un bouchon de polyéthylène glycol. Il est positionné à l’aveugle. 20 mL de sérum physiologique sont introduits puis ré-aspirés.
Tableau 4 : Caractéristiques des principaux types de prélèvements
| Prélèvement | Protégé | Fibroscopie | Avantages | Inconvénients |
| Expectoration | NON | Possible mais non indispensable | Simple à obtenir et non invasif | Forte contamination |
| Aspiration bronchique | NON | NON | Simple à obtenir | Contamination |
| Aspiration endotrachéale | NON | NON | Simple à obtenir | Contamination Prélèvement possible seulement si le patient est intubé |
| Lavage bronchoalvéolaire | NON | OUI | Explore une grande partie du territoire pulmonaire | Mal toléré par les patients |
| Brossage bronchique protégé | OUI | OUI | Prélèvement guidé sur un site précis | Faible volume de prélèvement Coût élevé |
| Aspiration bronchique distale protégée | OUI | Possible mais non indispensable | Bonne qualité même sans fibroscopie Faible coût |
Faible volume de prélèvement Pas de visualisation du site prélevé (en l’absence de fibroscopie) |
| Mini LBA | OUI | Possible mais non indispensable | Volume de prélèvement supérieur à celui de l’aspiration bronchique distale protégée | Faible volume de prélèvement Pas de visualisation du site prélevé (en l’absence de fibroscopie) |