Test génétique d’identification des gènes des shiga-toxines stx1 et stx2, du gène de l’intimine eae et du gène ipaH
Le test GenoType® EHEC est basé sur la technologie DNA STRIP® qui permet l’identification combinée des gènes des shiga-toxines stx1 et stx2, du gène de l’intimine eae et du gène ipaH (invasion plasmid antigene H).
La procédure complète comporte trois phases :
- extraction de l’ADN à partir de cultures (bactéries fraîchement cultivées en milieu solide ; matériel requis pour l’extraction de l’ADN non fourni),
- une amplification multiplex à l’aide d’amorces biotinylées (ADN polymérase thermostable non fournie),
- une hybridation inverse.
|
L’hybridation inverse comporte les étapes suivantes :
|
La matrice fournie avec le kit permet d’identifier chaque zone réactionnelle en alignant la bande de marquage de la bandelette et celle de la matrice.
Chaque bandelette comprend 7 zones réactionnelles (voir figure en dessous)
Contrôle de QualitéAfin de contrôler le bon déroulement du test et le bon fonctionnement des réactifs, chaque bandelette comporte 3 zones de contrôle :
|
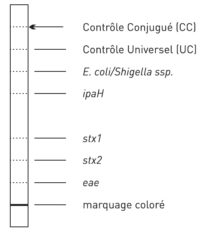 |
- une zone Contrôle E. coli/Shigella ssp
Au vue des connaissances actuelles, cette zone hybride avec toutes les espèces d’E. coli et les sous-espèces Shigella. Puisque le matériel de départ du test est une culture d’E. coli, cette zone devrait développer un signal positif.
L’amplification du contrôle peut néanmoins être atténuée par l’amplification du (des) séquence(s) spécifique(s).
A noter que les espèces appartenant aux genres Citrobacter et Klebsiella peuvent également réagir au niveau de la zone E. coli/Shigella ssp.
Bandes spécifiques
- la bande ipaH (invasion plasmid antigene H) reconnait une séquence d’ADN présente chez les Shigella et les EIEC
- les bandes stx1, stx2 contiennent des sondes reconnaissant des séquences spécifiques respectivement des gènes stx1 et stx2 présents chez les EHEC. Le gène stx présent chez Shigella dysenteriae sérotype 1 présente 99% d’homologie avec le gène stx1.
- la bande eae contient une sonde reconnaissant une séquence spécifique du gène eae présent chez les EPEC et certaines souches d’EHEC.
