La gélose Mueller-Hinton est un milieu standardisé recommandé pour l’étude de la sensibilité aux antibiotiques des bactéries peu exigeantes. Pour les bactéries exigeantes, comme, par exemple, les Streptococcus, les Haemophilus, Neisseria meningitidis, on utilise une gélose MH-F.
La gélose MH-F est une gélose MH enrichie avec du sang défibriné de cheval et du β-NAD (facteur V des Haemophilus).
La composition de la gélose Mueller-Hinton est standardisée
La composition et le conditionnement, des géloses Mueller-Hinton et MH-F, doivent être suffisamment maitrisées pour que les résultats obtenus lors de l’étude de l’activité des antibiotiques soient reproductibles.
Ainsi, il est important d’ajuster la concentration finale des cations Ca2+ et Mg2+ car elles influent sur l’activité des aminosides sur Pseudomonas aeruginosa et de la tétracycline sur les staphylocoques.
De même, la thymidine inhibe l’activité des sulfamides et du triméthoprime. Il faut alors que la concentration de la thymidine ne dépasse pas 50 µg/L. Pour respecter cette condition, on choisit des matières premières pauvres en thymidine. Ce taux de thymidine est déterminé indirectement en mesurant le diamètre d’inhibition autour d’un disque de triméthoprime-sulfaméthoxazole (SXT) avec une souche d’Enterococcus faecalis ATCC 29212.
L’activité de certains antibiotiques dépend aussi du pH. Le pH du milieu doit donc être contrôlé.
La diffusion des antibiotiques contenus dans les disques dépend de l’épaisseur de la gélose et de sa concentration en agar. L’épaisseur de la gélose doit être de 4 mm et cela sur toute la surface de la boite (la gélose doit donc être coulée sur une surface bien horizontale).
Il faut utiliser des géloses fraichement coulées et bien conservées pour éviter qu’elles se déshydratent. Si elles sont achetées, prêtes à l’emploi, il est important de respecter la date de péremption.
Ces géloses sont conditionnées dans deux types de boite de Petri :
- boite ronde de 90 mm de diamètre pour tester au maximum 7 disques
- boite carrée de 140 mm pour tester 16 disques.
Une utilisation standardisée
L’utilisation des milieux Mueller-Hinton et MH-F pour étudier la sensibilité des bactéries aux antibiotiques est standardisée afin de garantir, encore une fois, la reproductibilité des résultats. Elle est présentée en détail par le Comité de l’Antibiogramme de la Société Française de Microbiologie (CA-SFM) en collaboration avec l’EUropean Committee on Antimicrobial Susceptibility Testing (EUCAST). Ce comité rédige, tous les ans, un guide que vous pouvez télécharger sur le site internet de la SFM.
Voici un lien vers le communiqué d’avril 2020 du CA-SFM EUCAST.
Il s’agit de :
- Préparer une suspension d’une turbidité équivalente à celle de l’étalon 0,5 de Mac Farland en prélevant si possible plusieurs colonies.
- Plonger un écouvillon dans cette suspension et éliminer l’excès de liquide en tournant et pressant l’écouvillon contre la partie haute de la paroi du tube (la pression exercée est plus forte sur la partie haute sinon la tige de l’écouvillon se plie).
- Ensemencer, en stries serrées, avec l’écouvillon, la totalité de la surface du milieu dans trois directions (faire tourner la boite d’1/3 de tour entre chaque passage).
- Déposer les disques avec un distributeur ou bien à la pince en s’assurant qu’ils sont bien plaqués contre la gélose.
- Incuber en respectant les préconisations du CA-SFM/EUCAST : température, atmosphère et durée.
- Mesurer les diamètres d’inhibition autour des disques et les comparer aux diamètres critiques fixés par le CA-SFM/EUCAST afin de déterminer la catégorie clinique :
S : sensible à dose standard
SFE : sensible à forte exposition à l’antibiotique
R : résistant
Il faut également respecter certains délais :
- utiliser la suspension dans les 15 minutes qui suivent sa préparation et jamais au delà d’une heure.
- incuber les boites dans les 15 minutes qui suivent leur ensemencement et jamais au delà de 30 minutes.
D’autres précautions doivent être prises, elles ne sont pas toutes présentées ici, vous les trouverez dans le communiqué du CA-SFM/EUCAST.

Distributeur 16 disques d’antibiotiques |
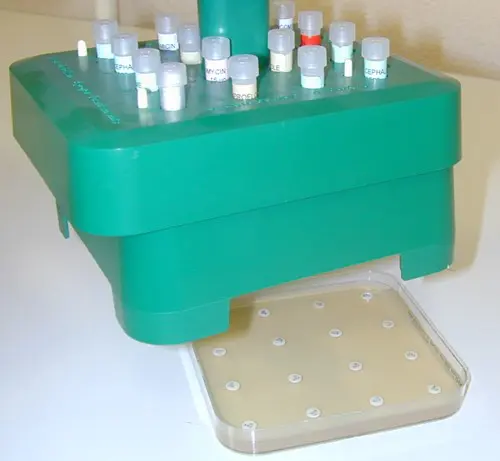
Dépôt des disques d’antibiotiques |
Contrôle interne de la qualité
Le contrôle interne de la qualité de cette méthode est réalisé avec des souches de collection. Il s’agit ensuite de consulter le communiqué du CA-SFM/EUCAST et de comparer le diamètre d’inhibition obtenu au diamètre d’inhibition cible et aux limites acceptables.
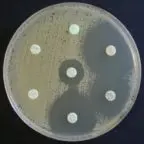
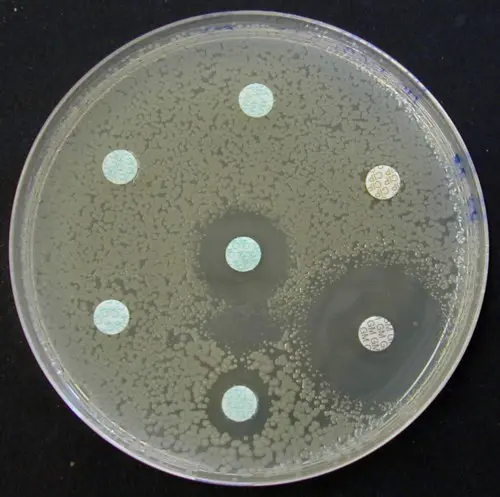
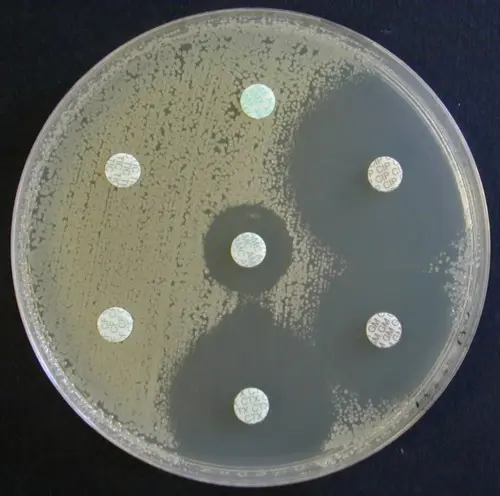
Exemples de résultats d’antibiogramme par la méthode des disques sur gélose Mueller-Hinton et MH-F
Antibiogramme sur MH d’une souche d’Escherichia coli BLSE |
Antibiogramme sur MH d’une souche de Klebsiella oxytoca pénicillinase haut niveau |
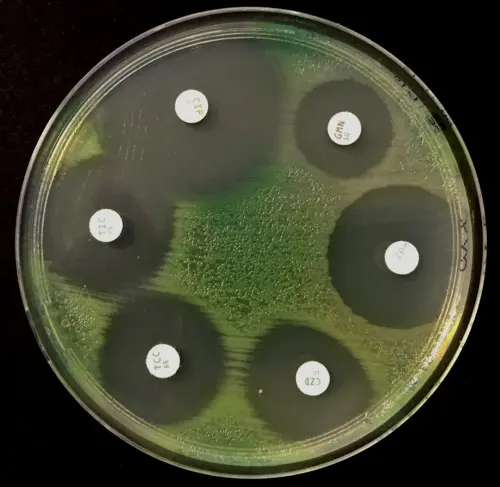
Antibiogramme sur MH d’une souche de Pseudomonas aeruginosa sauvage |
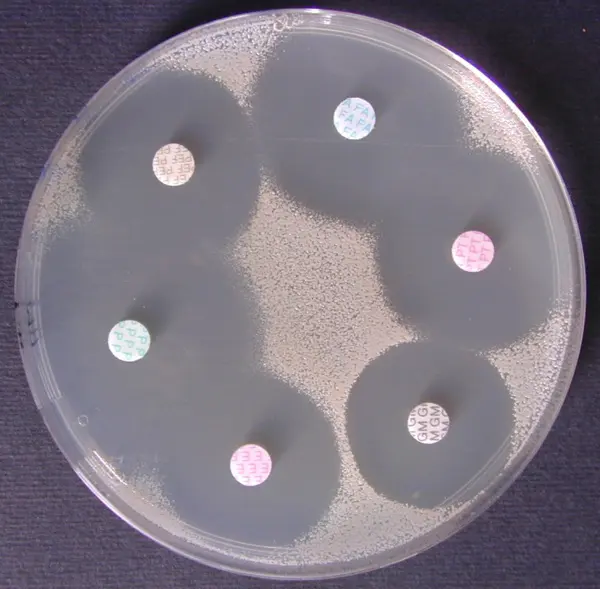
Antibiogramme sur MH d’une souche de Staphylococcus aureus sauvage |
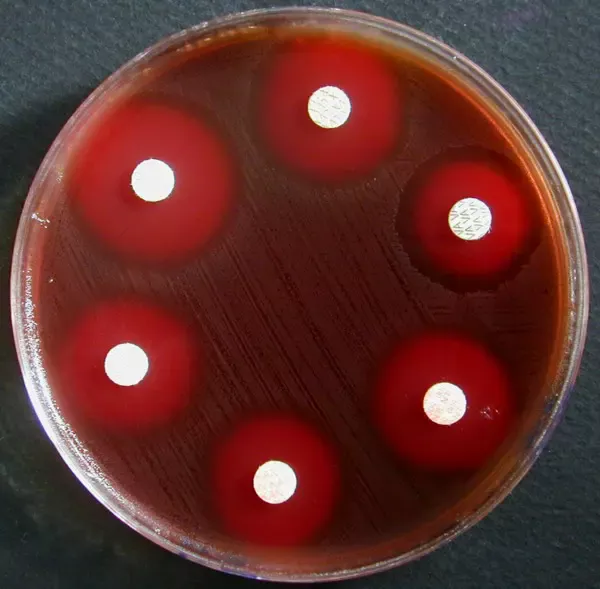
Antibiogramme sur MH-F d’une souche de Streptococcus G |

Antibiogramme sur MH d’une souche de Serratia marcescens |