PLAN
- Examen macroscopique
- Examens microscopiques
- Examens microscopiques des expectorations, aspirations bronchiques et endotrachéales
- Objectifs des examens microscopiques
- Éléments observés
- Évaluation de la qualité du prélèvement
- Description de la flore bactérienne
- Examens microscopiques des lavages bronchoalvéolaires
- Examens microscopiques des prélèvements protégés
- Culture et dénombrement
- Traitement des prélèvements
- Fluidification des expectorations, aspirations bronchiques et aspirations endo-trachéales
- Traitement des sécrétions de la brosse des BBP ou du cathéter distal protégé
- Protocoles pour une estimation quantitative de la concentration bactérienne
- Choix des milieux et mise en culture
- Interprétation
- Recherche adaptée à certains microorganismes
- Legionella spp.
- Mycoplasma pneumoniae
- Chlamydophila psittaci et Chlamydophila pneumoniae
- Mycobactéries
- Nocardia
- Bordetella pertussis
- Pneumocystis jirovecii
- virus
- Aspergillus
Examen macroscopique
Notons que cet examen macroscopique concerne seulement les expectorations, les aspirations bronchiques et les aspirations endotrachéales.
On décrira si l’aspect est :
- muqueux : donnant un aspect en gelée avec de rares parcelles purulentes ;
- mucopurulent : muqueux avec des parcelles de pus plus nombreuses ;
- salivaire ;
- fluide et purulent ;
- visqueux et adhérent.
Préciser aussi la couleur éventuellement : rouille, verdâtre, hémoptoïque (sang). Certaines caractéristiques permettent d’orienter le diagnostic. Ainsi, la présence de grains jaunes est caractéristique d’une actinomycose. De même, la perception (attention : ne pas sentir volontairement) d’une odeur fétide témoigne de la présence d’anaérobies.
 fluide et purulent |
 salivaire |
|
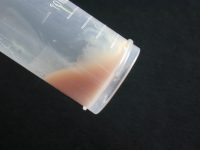 visqueux et adhérent visqueux et adhérent |
 muqueux |
|
| Fig.9 : Différents aspects macroscopiques de crachat © Pascal Fraperie |
||
Le crachat lors de pneumonie lobaire aiguë est, par exemple, fréquemment transparent, peu aéré, visqueux, très adhérent au récipient, de couleur rouille ou gelée de coing.
Examens microscopiques
Examens microscopiques des expectorations, aspirations bronchiques et endotrachéales
Objectifs des examens microscopiques
L’examen microscopique présente deux objectifs :
- évaluer la qualité du prélèvement en s’assurant d’une part qu’il n’a pas été trop contaminé lors du passage par les voies aérienne supérieures et d’autre part qu’il provient bien d’un foyer infectieux (présence de granulocytes neutrophiles).
- observer la flore bactérienne de l’expectoration afin d’orienter rapidement le diagnostic et choisir les méthodes pour le confirmer.
Éléments observés
Tout d’abord, c’est dans les parcelles purulentes que la probabilité de trouver l’agent infectieux est la plus grande. Il s’agit donc de prélever une parcelle purulente, de l’écraser entre 2 lames et de l’étaler sur 3 lames pour coloration au MGG, Gram et Ziehl-Neelsen.
- Le fond de la préparation se compose d’un mucus hyalin, bleu (au bleu de méthylène), réparti assez uniformément bien que formant des zones plus épaisses par endroits. Quelquefois (cas de la pneumonie), on pourra observer des formations d’un bleu plus foncé en forme de goutte. Il s’agit d’un exsudat séroalbumineux.
- Un réseau de fibrine plus ou moins dense, plus ou moins bien limité, parfois filamenteux, peut englober les granulocytes (pneumonie). Notons enfin que le mucus hyalin prédomine dans les crachats adhérents (pneumonie, au début dans la bronchite aiguë, congestion pulmonaire).
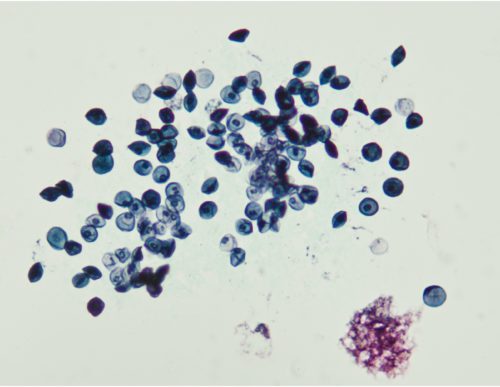
- La réaction inflammatoire se traduira par la présence de nombreux granulocytes neutrophiles.
- Des cellules d’origine variée peuvent être présentes : cellules épithéliales pharyngées, cellules bronchiques, macrophages alvéolaires.
- Les germes responsables de l’infection auxquels s’ajoutent des bactéries commensales des voies aériennes supérieures.
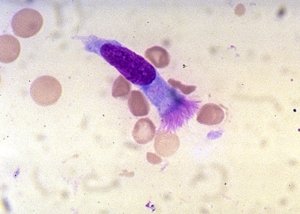
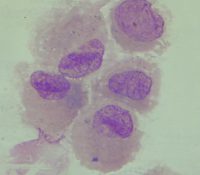
Cellules de l’épithélium pharyngé
Grandes cellules pavimenteuses, à petit noyau central, cytoplasme très abondant (Fig.10 et 11) = témoins de contamination salivaire.
Fig 10 : Cellules épithéliales pharyngées
© Canopé, 2013
Fig 11 : Cellule épithéliale pharyngée GRAM X1000
© Pascal Fraperie
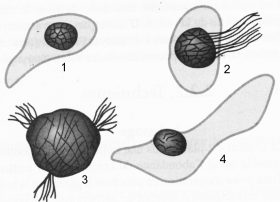
Cellules de l’épithélium bronchique
Le schéma d’une coupe transversale de bronche permet de localiser les cellules de l’épithélium bronchique. (Fig. 4 de la page mécanismes de défense).
On les retrouve, en fait, plus ou moins tuméfiées dans les crachats. En voici quelques aspects assez classiques (Fig. 12 et 13) :
1 — cellule bronchique peu déformée. Le noyau commence cependant à se tuméfier ;
2 — cellule bronchique dont le noyau, en dégénérescence réticulée plus avancée, s’est retiré sous l’influence de l’étalement ;
3 — aspect réticulé isolé : trace d’un noyau d’une cellule bronchique dont le cytoplasme à disparu ;
4 — cellule bronchique presque intacte en volume, mais dont le cytoplasme commence à s’altérer et le noyau à se tuméfier.
Fig 12 : Cellules de l’épithélium bronchique
© Canopé, 2013
Fig 13 : Cellules de l’épithélium bronchique
Cellules d’origine pulmonaire
On retrouve deux types de cellules d’origine pulmonaire dans les expectorations : les cellules alvéolaires et les macrophages
Cellules alvéolaires (Fig. 14)
Elles correspondent aux pneumocytes II (Fig. 5 de la page mécanismes de défense). Leur aspect est variable selon leur degré de maturité.
Fig 14 : Cellules alvéolaires
© Canopé, 2013
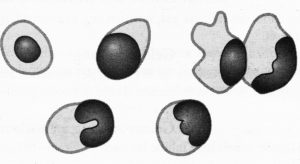
Macrophages (Fig. 15 et 16)
cellules à noyau excentrique et cytoplasme clair. Certaines sont chargées de grains d’hémosidérine et sont appelées « cellules poussière ».
Fig 15 : Macrophages alvéolaires
© Canopé, 2013
Fig 16 : Macrophages alvéolaires
© Pascal Fraperie
Évaluation de la qualité du prélèvement
On apprécie :
- d’abord, le degré de contamination par la salive (présence de cellules épithéliales pharyngées)
- puis l’intensité de la réaction inflammatoire (présence de granulocytes neutrophiles). En effet, en présence de nombreux leucocytes, on présume que le prélèvement provient bien d’un foyer infectieux.
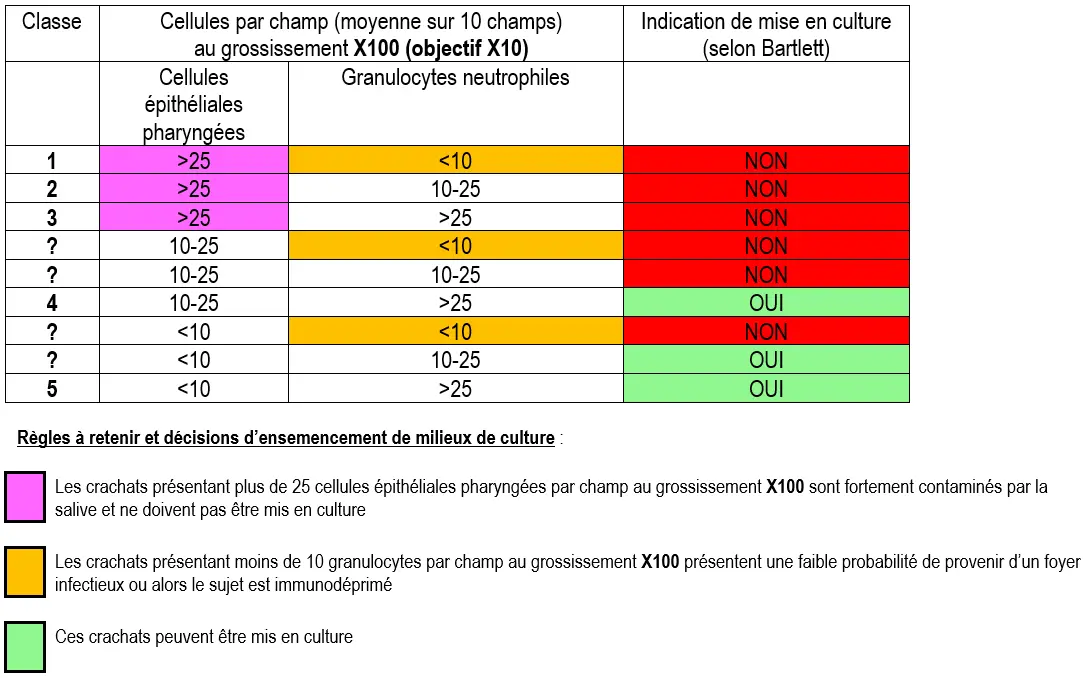
Pour cela, au grossissement 100 (objectif 10), on dénombre les cellules épithéliales pharyngées et les granulocytes neutrophiles par champ en faisant une moyenne sur 10 champs. C’est la méthode de Murray et Washington.
Les résultats permettent de distinguer 5 classes de crachats. Notons que pour certaines combinaisons de résultats, il n’a pas été donné de classe.
Tableau 4
Exemples
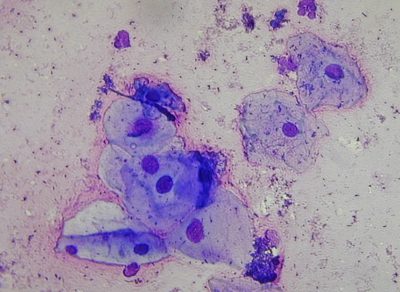 Fig 17 : Crachat de classe 1 (MGG au grossissement X400) © Pascal Fraperie |
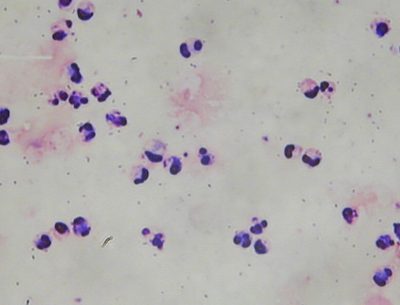 Fig 18 : Crachat de classe 5 (MGG au grossissement X400) © Pascal Fraperie |
Description de la flore bactérienne
Pour commencer, la flore bactérienne observée au Gram au grossissement x 1000 (objectif x 100) doit être décrite avec précision. Il est en particulier important de noter la prédominance d’un type bactérien car il est très probablement responsable de l’infection. Ensuite le résultat de cet examen doit être confronté à celui des cultures.
Examens microscopiques des lavages bronchoalvéolaires
Avec un LBA, les éléments nucléés et les hématies sont dénombrés en hématimètre (Kowaslide, Malassez..). En absence de pathologie, on dénombre entre 105 et 2.105 éléments/mL.
Ensuite, les autres examens microscopiques sont réalisés sur des frottis obtenus par cytocentrifugation.
Étant donné que ce type de prélèvement est adapté au diagnostic des pneumonies atypiques et de l’immunodéprimé, de nombreux types de microorganismes peuvent être recherchés. Ainsi les colorations à mettre en œuvre sont très variées :
- une coloration au MGG pour réaliser une formule leucocytaire (chez le sujet normal 85-90% de macrophages, 5-10% de lymphocytes et moins de 1% de granulocytes neutrophiles).
- une coloration de Gram pour observer la flore et en particulier la présence de bactéries à l’intérieur des polynucléaires neutrophiles (pour certains plus de 5% de granulocytes contenant des bactéries est un signe de pneumonie).
- la coloration de Ziehl-Neelsen pour la recherche des mycobactéries
- de l’immunofluorescence direct pour la recherche de Legionella ou de Pneumocystis jirovecii
- une coloration de Musto ou de Gomori-Grocott pour la mise en évidence de kystes de Pneumocystis jirovecii.
Examens microscopiques des prélèvements protégés
Dans ce cas, les frottis sont réalisés par cytocentrifugation. Notons que seules les colorations de MGG et de Gram sont conseillées pour ces échantillons. Ensuite les modalités de lecture sont identiques à celles du LBA.
Culture et dénombrement
Comme nous l’avons vu précédemment, le dénombrement des germes est indispensable pour distinguer une infection d’une légère colonisation ou d’une contamination du prélèvement par la salive. Les prélèvements seront traités de façon à ce que ce dénombrement soit possible.
Traitement des prélèvements
Fluidification des expectorations, aspirations bronchiques et aspirations endo-trachéales
Effectivement, la fluidification (ou homogénéisation) des expectorations, aspirations bronchiques et aspirations endo-trachéales est nécessaire pour obtenir un produit fluide sur lequel il est possible de faire des dilutions. Elle permet également de libérer les germes emprisonnés dans la masse de mucus.
La N-acétylcystéine, contenue dans les fluidifiants, rompt les ponts disulfures de la protéine formant le mucus, la mucine.
|
Il existe de nombreux protocoles pour réaliser cette fluidification, par exemple :
Ces mélanges se font dans un tube à vis stérile. ATTENTION : l’ouverture du tube se fera obligatoirement sous un PSM = risques majeurs de génération d’aérosols infectieux |
 Fig 19 : Fluidification d’un produit d’expectoration © Pascal Fraperie |
Traitement des sécrétions de la brosse des BBP ou du cathéter distal protégé
Les sécrétions seront décollées après agitation au vortex.
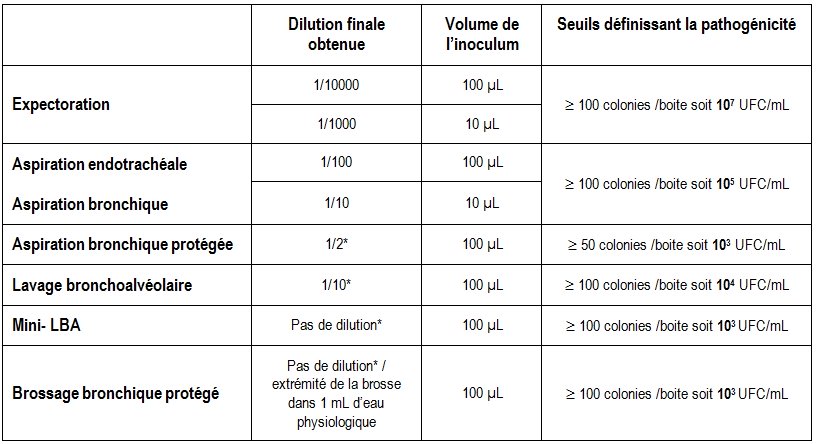
Protocoles pour une estimation quantitative de la concentration bactérienne
On choisit le taux de dilution du prélèvement et le volume déposé sur les milieux de culture en fonction du seuil de pathogénicité. L’objectif étant d’obtenir environ 100 UFC (Unité Formant Colonie) par boite quand la concentration en germe correspond au seuil de pathogénicité.
Par exemple, pour un crachat ou une aspiration bronchique, le seuil de pathogénicité étant de 107 UFC/mL, on peut :
- réaliser un isolement avec une anse calibrée de 10 µL à partir d’une dilution finale 10-3 du crachat (homogénéisation + dilution)
- ou bien étaler 100 µL avec un râteau d’une dilution finale 10-4 du crachat (homogénéisation + dilution)
Tableau 5 : Protocoles pour un dénombrement des germes selon le type de prélèvement
* notons que si l’examen microscopique montre la présence de nombreux germes, une série de milieux supplémentaires sera ensemencée avec une suspension 100 fois plus diluée.
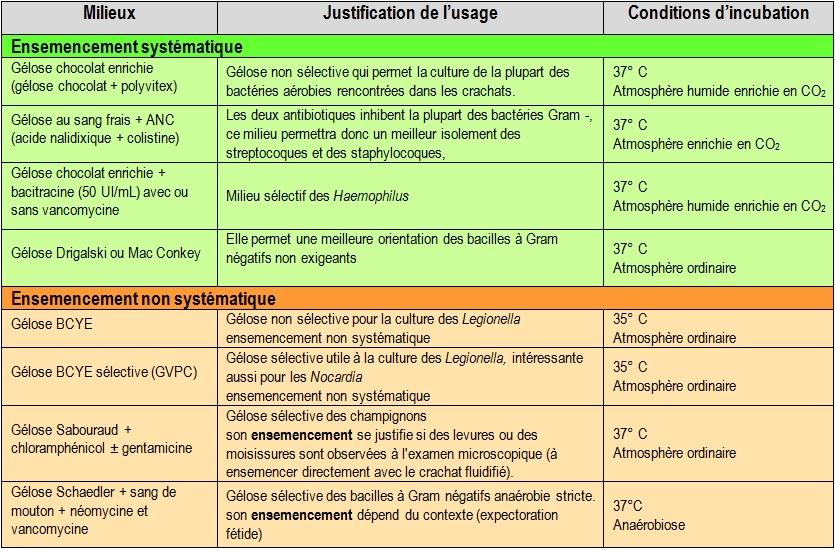
Choix des milieux et mise en culture
La liste des milieux ensemencés est généralement déterminée à l’avance et dépend des germes recherchés et donc des contextes cliniques (Cf Tableau 6).
Tableau 6 : Milieux et conditions de culture
Enfin des milieux supplémentaires sont ensemencés dans le cas de recherches particulières (recherches adaptées à certains microorganismes)
Interprétation
De nombreux microorganismes responsables d’infections bronchopulmonaires proviennent des flores commensales des voies aériennes supérieures et peuvent coloniser les voies aériennes inférieures sans pour autant provoquer une infection. Pour cette raison, il est nécessaire de distinguer une colonisation d’une infection. C’est pourquoi il faut connaitre la concentration des différents germes dans le prélèvement. En effet, on considère qu’un germe est responsable d’une infection bronchopulmonaire si sa concentration dans le prélèvement dépasse un certain seuil. Notons que les seuils retenus dépendent du mode de recueil des sécrétions.
L’interprétation des résultats doit également prendre en compte l’ensemble des résultats biologiques et des renseignements cliniques.
Les seuils définissant la pathogénicité peuvent par exemple être abaissés dans les cas suivants :
- observation d’une flore monomorphe pathogène à l’examen direct
- antibiothérapie administrée avant de réaliser le prélèvement
- malade immunodéprimé ou mucoviscidosique
Tableau 7 : Seuils définissant la pathogénicité selon les modalités du prélèvement
| Modalités de prélèvement | Seuil définissant la pathogénicité |
| Expectoration | 107 UFC/mL 1 et 2 |
| Aspiration endotrachéale et bronchique | 105 UFC/mL |
| Aspiration bronchique protégée | 103 UFC/mL |
| Lavage bronchoalvéolaire | 104 UFC/mL 3 |
| Mini LBA | 103 UFC/mL |
| Brossage bronchique protégé | 103 UFC/mL |
1 Pour certains auteurs l’examen bactériologique d’une expectoration en routine doit être proscrit : en effet, ses résultats sont aléatoires en raison de la contamination salivaire.
2 Pour un prélèvement de bonne qualité, on peut se poser la question de la conduite à tenir face à la présence de bactéries commensales d’origine oropharyngée (supérieure ou égale à 107 UFC par mL : streptocoques non hémolytiques, corynébactéries, par exemple). La confrontation bioclinique est là indispensable pour la suite à donner à l’examen.
3 Pour les bactéries des genres Nocardia, Legionella, Mycobacterium, Actinomyces, leur présence dans un LBA à des concentrations inférieures à 104 UFC/mL sera prise en compte.
Recherche de Legionella spp.
Les Legionella sont des bacilles à Gram négatif, droits, souvent fusiformes, intra ou extra cellulaires, de 4 µm de long pour 0,5 à 0,7 µm de large ; on peut observer des formes filamenteuses.
L’examen microscopique apporte rarement des éléments décisifs.
La recherche d’antigènes urinaires
Elle est primordiale car elle permet un diagnostic précoce et rapide des cas de Legionella pneumophila sérogroupe 1, ce sérotype représentant plus de 90 % des légionelloses. Devant toute recherche d’antigène urinaire positive et en présence d’une pneumonie, la légionellose est confirmée.
L’isolement d’une souche par culture puis son identification reste indispensable pour l’enquête épidémiologique.
Les souches sont envoyées au CNR des Legionella pour confirmation de l’identification et leur typage.
Le prélèvement le mieux adapté et donnant le plus fort taux de positivité est le lavage broncho-alvéolaire. Si l’état clinique du patient ne permet pas ce prélèvement, il est cependant possible d’isoler des légionelles à partir d’expectorations ainsi que de tout autre type de prélèvements pulmonaires (aspirations trachéales, biopsies pulmonaires, liquide pleural…).
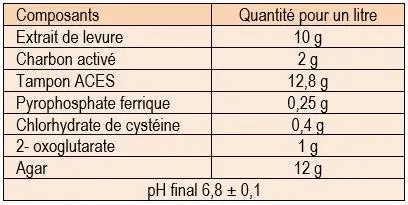
Les Legionella sont des bactéries très exigeantes qui ont besoin pour leur croissance de milieux contenant du fer et de la cystéine. Le milieu de choix est la gélose BCYE (Buffered Charcal Yeast Extract). Mais cette gélose non sélective ne convient pas à la recherche des Legionella dans les prélèvements plurimicrobiens, comme les sécrétions bronchopulmonaires. Il faut alors ensemencer une gélose sélective, appelée GVPC, qui correspond à une gélose BCYE dans laquelle ont été ajouté de la glycine, de la vancomycine, de la polymyxine B et du cycloheximide.
Tableau 8 : Composition de la gélose BCYE
Les milieux doivent être placés dans une atmosphère ordinaire (attention : la culture est inhibée en présence de 5 % de CO2).
|
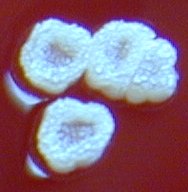
L’incubation est faite à 35°C ±1°C sous atmosphère ordinaire pendant 10 jours avec une lecture à J3, J5 et J10. Les colonies suspectes sont repiquées :
Les Legionella ne cultivent pas sur milieu BCYE sans cystéine, ni sur la gélose au sang |
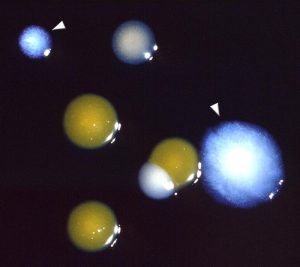
Fig 19 : Colonies de Legionella pneumophila sur BCYE cystéiné (suivre flèches) |
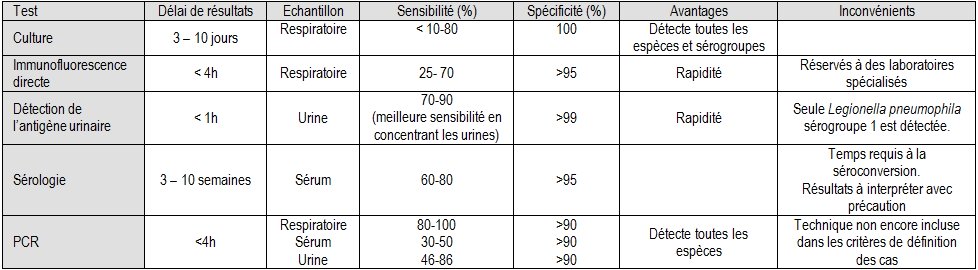
D’autres méthodes peuvent compléter le diagnostic par recherche d’antigènes urinaires et par culture
- la PCR sur les LBA présente une bonne sensibilité (probablement meilleure que la culture) et une grande spécificité.
- l’immunofluorescence directe sur le culot.
- la sérologie : en France, l’immunoflurescence indirecte est la méthode de référence. Mais le délai élevé pour obtenir les résultats et l’existence de faux positifs font de la sérologie un outil peu performant pour le diagnostic, elle présente cependant un intérêt épidémiologique.
Tableau 9 : Comparaison des méthodes de diagnostic des legionelloses
Tiré de l’article de David R Murdoch : « Diagnosis of Legionella infection », Clin Infect Dis, 2003 ; 36(1) : 64-69
Recherche de Mycoplasma pneumoniae
Les mycoplasmes sont des bactéries de très petite taille et ne prenant pas la coloration de Gram.
La culture de Mycoplasma pneumoniae et la détection rapide des antigènes ne sont pas utilisées pour le diagnostic.
La culture est trop longue et délicate, la détection des antigènes peu sensible et peu spécifique.
Le diagnostic est plus souvent réalisé par la PCR et la sérologie.
Les prélèvements recommandés sont le brossage bronchique protégé ou le lavage bronchoalvéolaire. Etant donné le caractère diffus de l’infection, il est possible aussi de les rechercher dans un prélèvement de gorge ou une aspiration nasopharyngée, l’écouvillon utilisé doit être aussitôt placé dans un milieu de transport (milieu 2 SP).
Des protocoles de PCR en temps réel amplifient par exemple une séquence du gène de l’adhésine P1 (facteur de pathogénicité essentiel, présent seulement chez cette espèce)
En sérologie
Les techniques ELISA sont les plus pratiquées en raison de leur meilleure sensibilité et spécificité. Elles permettent de titrer séparément les IgM, IgG et IgA dirigés contre des antigènes de Mycoplasma pneumoniae.
Mycoplasma pneumoniae n’appartient pas à la flore commensale mais en période épidémique de nombreux sujets peuvent être colonisés sans développer pour autant une infection. Alors que les méthodes de culture ou d’amplification génique ne permettent pas de distinguer un état de colonisation d’un état d’infection, la sérologie est contributive. En effet les anticorps anti-Mycoplasma pneumoniae sont secrétés seulement lors d’une infection.
Une infection récente se traduit par la présence d’Ig M chez l’enfant et l’adolescent et d’IgA chez l’adulte (comme chez l’adulte il s’agit dans la plupart des cas de réinfection, il est rare de retrouver des IgM)
Si le diagnostic est tardif, il s’agit alors de comparer les titres en IgG sur deux sérums prélevés à 15 jours d’écart minimum (comparaison très recommandée car des Ig G peuvent persister longtemps chez un individu ayant déjà développé une infection à Mycoplasma pneumoniae).
Recherche de Chlamydophila psittaci et Chlamydophila pneumoniae
Ces bactéries ne sont pas observables après une coloration de Gram.
Le diagnostic des infections respiratoires à ces deux espèces est encore problématique. Il est recommandé d’associer la sérologie à la mise en évidence de la bactérie par PCR.
Comme pour Mycoplasma pneumoniae, le diagnostic sérologique des infections à Chlamydophila pneumoniae est d’interprétation difficile et repose sur l’ascension du titre des IgG spécifiques sur 2 sérums à 3 semaines d’intervalle minimum accompagnées ou non d’IgM, en cas de primo-infection.
Recherche des Mycobactéries
La recherche des mycobactéries est traitée dans diagnostic des infections à mycobactéries
Recherche de Nocardia
Elle s’effectue principalement sur les LBA.
Examen direct
Il est capital pour orienter l’identification. Le diagnostic présomptif de nocardiose repose sur l’observation de bacilles à Gram positif filamenteux et quelquefois ramifiés, de coloration irrégulière (Fig.20).
Ils présentent une légère acido-alcoolo-résistance, suffisante pour apparaître roses sur fond bleu à la coloration de Kinyoun modifiée. On note qu’ils résistent également à la décontamination visant à sélectionner les mycobactéries.
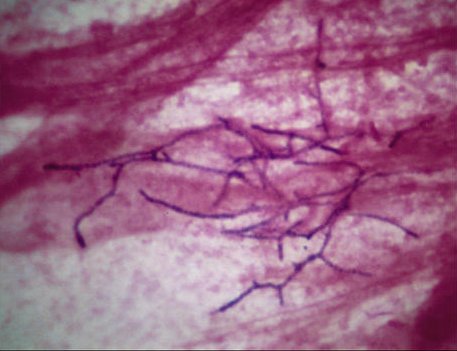
© Jean-Luc Gestin
Culture
De nombreux milieux conviennent à la culture des Nocardia : BCP, Columbia au sang de mouton, gélose chocolat enrichie, gélose Sabouraud, BCYE, Loewenstein Jensen.
Pour faciliter leur isolement dans un prélèvement polymicrobien, la gélose BCYE sélective est intéressante.
Notons que le temps de croissance dépend de l’espèce et du milieu de culture utilisé. Ainsi il peut varier de 2 à 15 jours.
La morphologie et la couleur des colonies varient d’une espèce à une autre cependant un grand nombre d’espèces se caractérisent par une incrustation des colonies dans la gélose et par une odeur de terreau. La présence fréquente d’hyphes aériens se traduit par une coloration blanche, des colonies apparaissant de loin comme « saupoudrées de sucre » (Fig.21).
Identification
Les caractères phénotypiques ne suffisent pas pour identifier le genre, notons cependant que les Nocardia sont catalase +, nitrate réductase + et ONPG +.
Actuellement il est possible d’identifier le genre Nocardia par PCR-RFLP. C’est une méthode au cours de laquelle est amplifiée une région de 600 pb du gène de l’ARN16S suivie d’une digestion enzymatique avec les enzymes de restriction Mnl1 et Sac1 (les Nocardia présentent un site de restriction pour l’enzyme Mnl1 et aucun site pour l’enzyme Sac1).
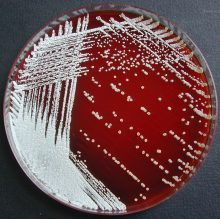
Fig 21 : Culture de Nocardia cyriacigeorgica sur gélose au sang
© Pascal Fraperie
L’identification des espèces est confiée à des laboratoires spécialisés. Les méthodes d’identification actuellement les plus performantes font appel au séquençage partiel des gènes hsp65, rpoB et sod et du gène codant pour l’ARN 16S. Des outils bio-informatiques permettent de comparer les séquences obtenues à celles présentes dans des banques génomiques.
L’Université de Lyon 1 qui est aussi l’observatoire français des nocardioses a développé la banque génomique BIBI (bioinformatic bacterial identification), disponible sur internet https://umr5558-bibiserv.univ-lyon1.fr/lebibi/lebibi.cgi
Recherche de Bordetella pertussis
Bordetella pertussis est l’agent de la coqueluche, une infection aiguë des voies respiratoires basses caractérisée par des quintes de toux spasmodiques.
Le diagnostic bactériologique de la coqueluche se fait sur un prélèvement rhinopharyngé.
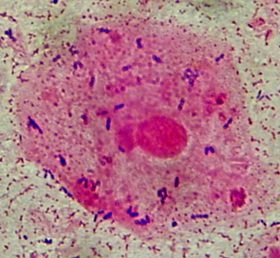
Recherche de Pneumocystis jirovecii
Pneumocystis jirovecii est un champignon responsable d’infection pulmonaire très grave, survenant chez des sujets immunodéprimés, en particulier les malades du SIDA.
Le diagnostic repose sur l’examen microscopique d’un LBA après cytocentrifugation. La coloration de MGG permet de révéler les formes végétatives alors que les colorations de Gomori-Grocott ou Musto mettent en évidence les kystes.
Les formes végétatives sont des éléments arrondis ou ovalaires de 1,5 à 3,5 µm contenant un noyau violet.
La morphologie des kystes évolue au cours de leur maturation : les jeunes kystes font de 3 à 6µm et possèdent un noyau, les plus âgés font 7 à 8µm et présentent jusqu’à 8 noyaux. Les kystes sont souvent disposés en amas et présentent un aspect de « grains de raisin vidés ».
Fig 22. Kyste de Pneumocysitis jirovecii
© Marc Pihet – CHU d’Angers
Recherche des virus
Le diagnostic des infections virales respiratoires se réalise à partir d’aspiration nasopharyngée ou d’écouvillonnage des fosses nasales.
Auparavant, il n’existait aucune technique de diagnostic rapide puisque seules la culture virale et la sérologie étaient employées. Désormais il est possible de mettre en évidence dans les échantillons respiratoires soit un antigène viral par des techniques immunologiques soit un fragment du génome viral par PCR.
Exemples :
- recherche d’antigène viral : Virus respiratoire syncitial (VRS) par méthode immunoenzymatique, Virus de la grippe influenza A et B par méthode immunochromatographique
- ou recherche de génome viral : l’avenir est aux méthodes PCR multiplex capables de rechercher simultanément la présence de différents.
Recherche des Aspergillus
Examen microscopique
Dans le cas d’une aspergillose, on observe, à l’examen microscopique, des filaments mycéliens septés, de taille régulière, ramifiés et des conidies arrondies. Comme les têtes aspergillaires sont rarement observées et que d’autres moisissures forment des filaments semblables aux Aspergillus, il faut attendre le résultat des cultures pour s’assurer du diagnostic. Il est tout de même recommandé de prévenir immédiatement le clinicien, afin de débuter un traitement antifongique, le pronostic étant très défavorable chez les immunodéprimés.
Culture
Les Aspergillus cultivent sur gélose Sabouraud + chloramphénicol ± gentamicine (mais ce milieu ne doit surtout pas contenir d’actidione, cette dernière inhibant leur culture). On incube la gélose à 37°C.
L’identification de l’espèce repose sur les examens macroscopique et microscopique de la culture. L’espèce la plus fréquemment isolée est Aspergillus fumigatus (Fig. 22 et 23).
 Fig 23 : Aspect de la culture recto/verso sur milieu Sabouraud d’Aspergillus fumigatus © Pascal Fraperie |
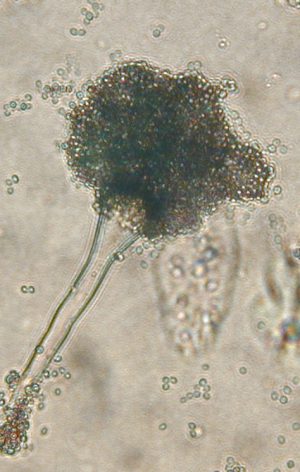 Fig 24 : Tête aspergillaire d’Aspergillus fumigatus Fig 24 : Tête aspergillaire d’Aspergillus fumigatus© Pascal Fraperie |
L’isolement d’un Aspergillus ne permet pas de conclure systématiquement à une aspergillose car ce sont des saprophytes fréquents.
Interprétation
Le rôle pathogène d’un Aspergillus isolé dans un prélèvement est d’autant plus probable que :
- l’examen direct est positif,
- la culture est abondante et rapide dans les tubes placés à 37°C,
- le prélèvement a été le plus protégé possible : LBA, aspiration endotrachéale.
Le prélèvement sera, autant que possible, renouvelé.
Autres tests
Il existe également des tests détectant dans le sérum ou le LBA, un antigène polyosidique de l’organe de fructification d’Aspergillus : le galactomannane. Ces tests, effectués deux fois par semaine, sont particulièrement utiles pour le suivi des patients aplasiques.