PLAN
- Anatomie fonctionnelle du cœur
- Physiopathologie des endocardites
- Signes cliniques
- Épidémiologie et germes en cause
- Diagnostic au laboratoire des endocardites infectieuses
Anatomie fonctionnelle du cœur
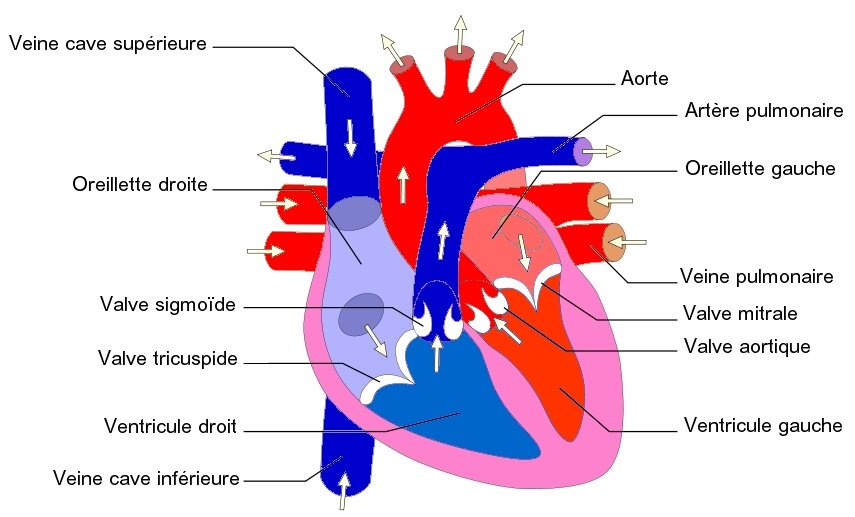
Le cœur est un muscle creux, qui réunit deux parties indépendantes : le cœur droit et le cœur gauche.
Chaque partie, droite et gauche, se compose d’une oreillette qui reçoit le sang des veines et d’un ventricule qui en se contractant expulse le sang dans les artères.
L’oreillette droite reçoit du sang désoxygéné de diverses parties de l’organisme par les veines caves et le sinus coronaire. Elle l’envoie ensuite dans le ventricule droit qui lui l’expulse dans l’artère pulmonaire. Là le sang est débarrassé du gaz carbonique et alimenté en dioxygène. Le sang oxygéné retourne au cœur par les veines pulmonaires qui le déversent dans l’oreillette gauche. Il passe ensuite dans le ventricule gauche qui en se contactant le propulse dans l’aorte. De là le sang est conduit dans les capillaires de tous les organes du corps, puis retourne au cœur droit par les veines caves.
Les 4 valves cardiaques, sous l’action des variations de pression produites par la contraction et la relaxation du cœur, forcent le sang à circuler dans une seule direction. En effet, elles s’ouvrent pour le laisser passer, puis se ferment pour l’empêcher de refluer. Bien évidemment, leur étanchéité est indispensable au bon fonctionnement du cœur en tant que pompe.
L’endocarde tapisse la surface interne du cœur et recouvre les valves cardiaques. Il comporte un endothelium (revêtement pavimenteux simple) reposant sur une couche de tissu conjonctif contenant des fibres de collagène et des fibres élastiques.
Fig. 1 : Circulation du sang dans le cœur
à partir de CC-BY-SA-3.0, via Wikimedia Commons
Physiopathologie des endocardites
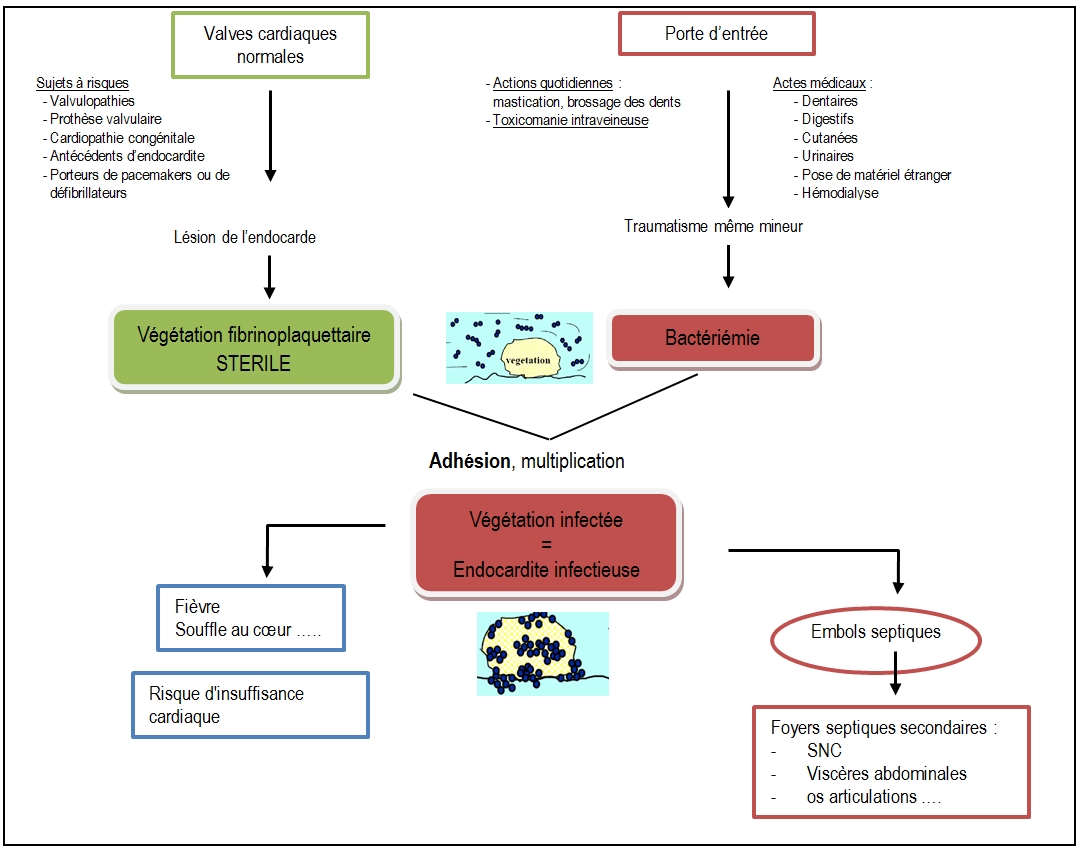
L’endocardite infectieuse résulte de la colonisation, par des bactéries circulant dans le sang, d’une végétation fibrinoplaquettaire initialement stérile qui s’est développé sur un endocarde lésé (valvulopathie, dégénérescence due à la vieillesse, présence de matériel étranger, inflammation lié à un rhumatisme articulaire aigu)
Les germes se fixent puis se multiplient et se recouvrent peu à peu de thrombocytes et de fibrine. Ainsi la végétation s’accroit par formation de couches successives. En outre, il peut y avoir plusieurs végétations. Elles mesurent de quelques millimètres à un centimètre ou plus. Très souvent, elles se situent sur les valves cardiaques et perturbent alors leur fonctionnement (leur étanchéité) à l’origine d’insuffisance cardiaque. La population bactérienne au sein de ces végétations infectées est très élevée. En outre, les bactéries les plus profondément enfouies sont peu accessibles à l’action des antibiotiques.
La végétation septique constituée de fibrine, de plaquettes et de bactéries peut se fragmenter en embols (septiques ou non). Ces embols vont ensuite se disséminer dans l’organisme. L’infection se généralise alors et les complications sont multiples : risque d’embolies (obstructions de vaisseaux notamment au niveau du SNC), d’infections à distance (foyers secondaires : SNC, viscères abdominales, os, articulations..) de vascularites (dépôts de complexes immuns induisant une inflammation de la paroi des vaisseaux sanguins) etc..
Fig.2 : Physiopathologie des endocardites infectieuses
© Marielle Maye-Lasserre
Signes cliniques
Les signes cliniques sont variables.
On observe le plus souvent une fièvre (presque toujours constante) associée à un souffle cardiaque. La perte d’appétit, une anémie, une splénomégalie et des infections métastasiques sont presque toujours présents.
Parfois il y a des signes cutanés évocateurs (pétéchies, érythèmes, nodosités..).
L’insuffisance cardiaque est la 1ère cause de mortalité à la phase aiguë de l’infection suivie par les complications neurologiques.
Épidémiologie et germes en cause
L’endocardite infectieuse est une pathologie assez rare (incidence estimée en France à 31 cas /an/ million d’habitants) mais grave avec une mortalité élevée (20 à 30%) en l’absence de traitement adapté.
On différencie les endocardites infectieuses à hémocultures positives des endocardites infectieuses à hémocultures négatives
Endocardite infectieuse à hémocultures positives
Le profil épidémiologique a considérablement changé ces dernières années :
- Autrefois l’endocardite infectieuse touchait surtout le jeune adulte atteint d’une valvulopathie bien identifiée (souvent d’origine rhumatismale).
- Actuellement elle touche surtout des patients plus âgés dont une proportion significative n’a pas de valvulopathie identifiée. Les personnes porteuses de prothèses valvulaires, les patients ayant une cardiopathie congénitale et ceux qui ont un antécédent d’endocardite infectieuse sont les plus à risque de développer cette pathologie. Les portes d’entrée à l’origine de bactériémies transitoires se sont diversifiées : les actes médicaux invasifs (comme les explorations endovasculaires, l’hémodialyse, l’implantation de stimulateurs cardiaques ou de chambres implantables sous-cutanée pour perfusions intraveineuses) et la toxicomanie intraveineuse ont supplanté les soins dentaires.
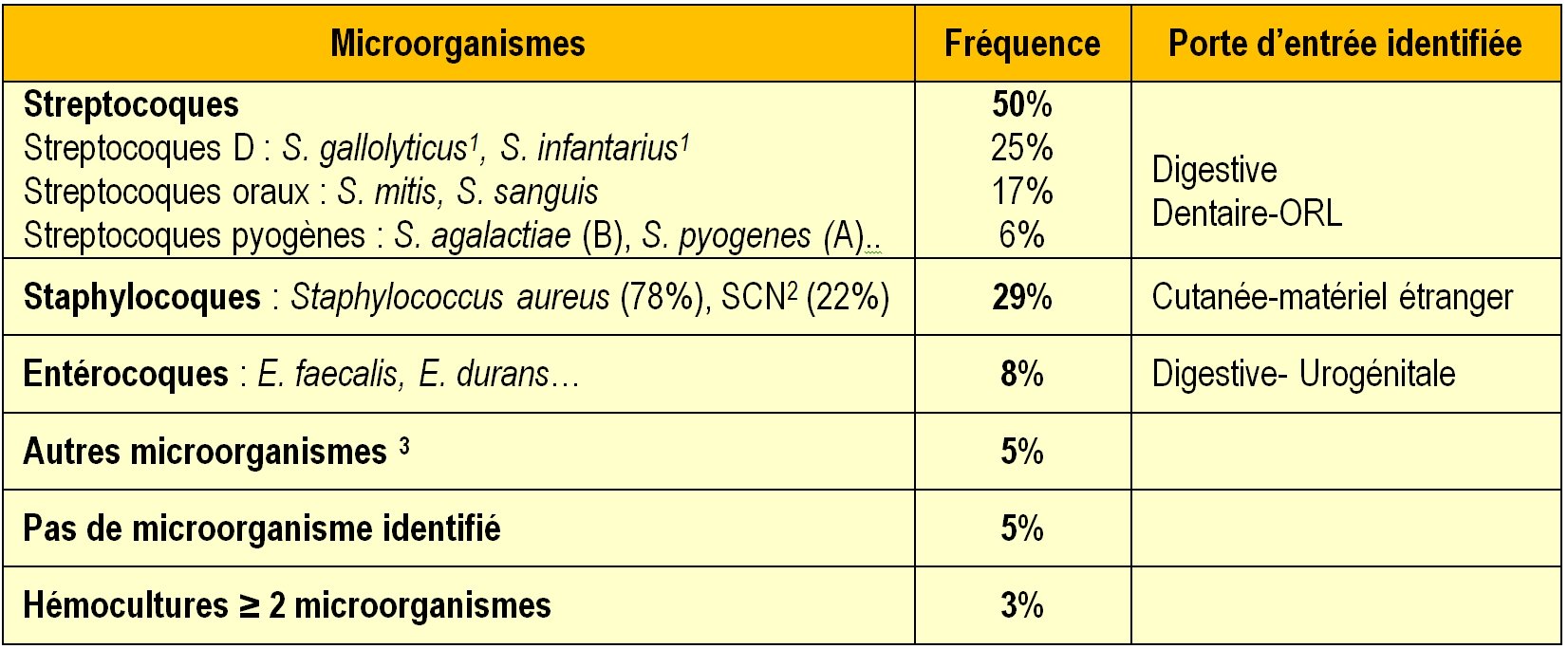
- La répartition des germes en cause a aussi été modifiée (Tableau 1):
- Augmentation de la fréquence de certains streptocoques : Streptococcus gallolyticus subsp. gallolyticus anciennement nommé S. bovis biotype I est le plus fréquent (souvent en cas de tumeurs du tube digestif). La place des entérocoques est stable (porte d’entrée urinaire ou digestive). La fréquence des streptocoques non groupables (=streptocoques « viridans ») a diminué ;
- Augmentation de la fréquence des staphylocoques : Staphylococcus aureus (porte d’entrée cutanée) et Staphylococcus epidermidis (sur prothèses cardiaques essentiellement)
Tableau 1 : Microorganismes responsables d’endocardites infectieuses en France (source REMIC 2010)
1 ces 2 espèces faisaient auparavant partie de l’espèce S. bovis ;
2 Staphylocoques à coagulase négative ;
3 parmi les autres germes identifiés se trouvent des bacilles à Gram négatif (Enterobacter aerogenes, Klesiella oxytoca ; Legionella spp).
Endocardite infectieuse à hémocultures négatives
On parle d’endocardite infectieuse à hémoculture négative quand plusieurs séries d’hémocultures n’ont pas montré de signes de positivité.
Elles représentent environ 10 % des cas d’endocardites infectieuses (entre 2,5 et 31% selon les études).
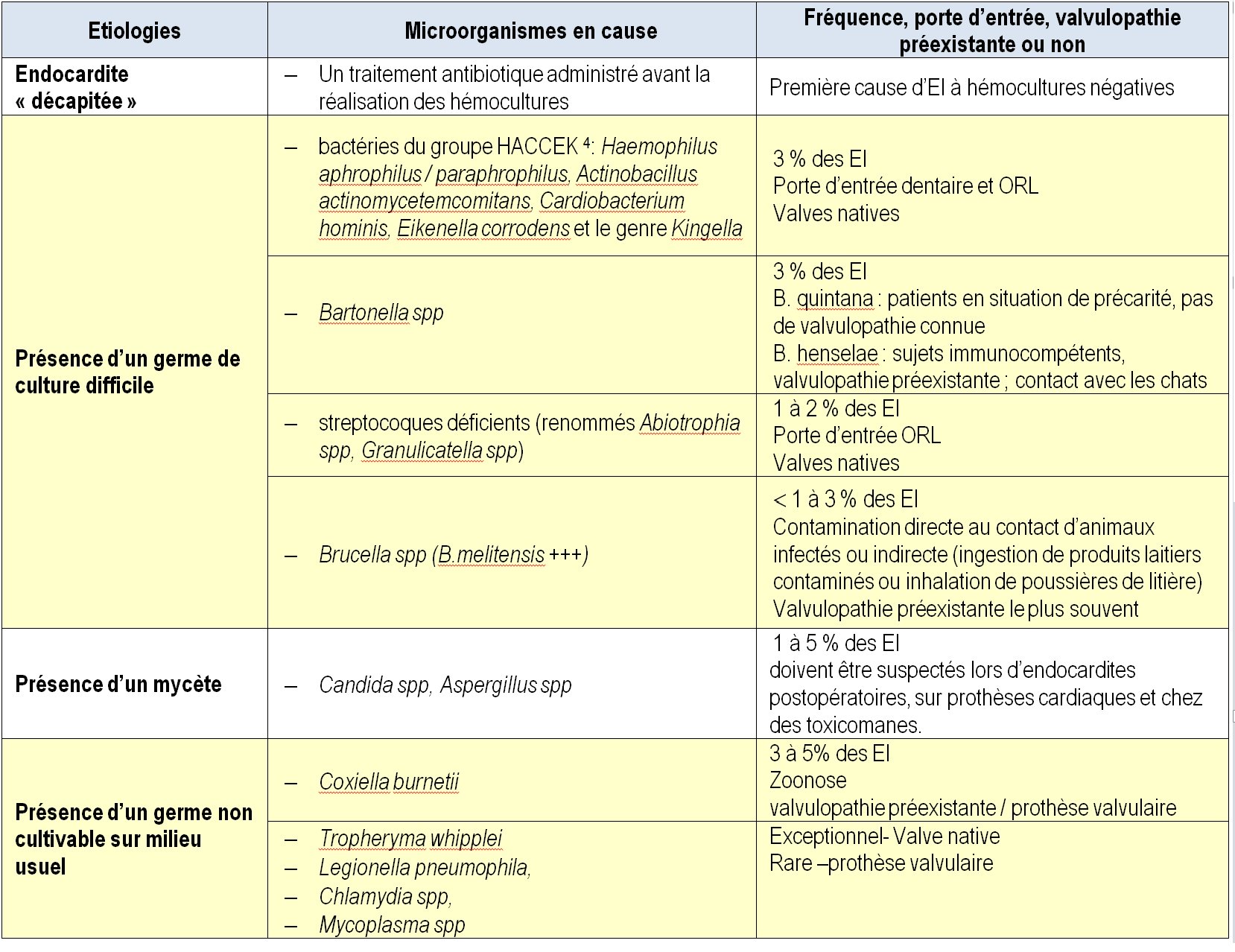
Les principales causes de la négativité des hémoculture lors d’endocardites sont rassemblées dans le tableau 2. La première cause est l’administration au patient d’un traitement antibiotique avant la réalisation des hémocultures ce qui a « décapitée » l’infection.
Des techniques autres que les hémocultures ont permis ces dernières années de mettre en cause des microorganismes de croissance difficile ou impossible sur milieux habituels.
Bartonella
Ce sont des bactéries intracellulaires facultatives qui parasitent les hématies et transmises en général par des arthropodes hématophages. Plusieurs espèces peuvent être responsables d’endocardites :
- Bartonella quintana est responsable de la « fièvre des tranchées » , actuellement dite « urbaine ». La bactérie a pour unique réservoir l’homme et se transmet par les poux. C’est pourquoi ces infections touchent particulièrement des individus obligés de vivre dans des conditions d’hygiène précaire (SDF) ou dans des camps de réfugiés. Cette fièvre se caractérise par des accès fébriles qui se succèdent tous les 5 jours environ d’où son nom de fièvre quintane.
- B.henselae est l’agent de la maladie des griffes du chat, infection bénigne se manifestant le plus souvent par une adénopathie régionale persistante après griffure ou morsure d’un chat contaminé. Il peut être responsable d’endocardites chez des sujets porteurs de valvulopathie.
Coxiella burnetii
Cette bactérie est responsable de la fièvre Q, zoonose ubiquitaire. Les mammifères animaux infectés éliminent la bactérie dans leur environnement par leurs déjections et massivement lors de la mise-bas. L’homme s’infecte en inhalant des poussières contaminées avec ces produits de parturition ou bien par ingestion de produits laitiers non pasteurisés. C’est une bactérie intracellulaire obligatoire qui se multiplie dans les phagolysosomes à pH 5 des macrophages des hôtes qu’elle infecte. Elle est responsable d’endocardite sur prothèse valvulaire ou sur valves cardiaques présentant des lésions.
Tropheryma whipplei
C’est l’agent de la maladie de Whipple, maladie longtemps considérée comme une maladie digestive chronique. En fait l’infection atteint plusieurs organes : le patient présente des signes digestifs (le plus souvent), des arthralgies et/ ou des adénopathies éventuellement associées à des lésions cérébrales ou cardiaques. Il est possible que le patient souffre d’une endocardite isolée, sans atteinte digestive, ce qui rend le diagnostic particulièrement difficile. Cette infection atteint surtout les hommes d’environ 50 ans ayant des anomalies immunitaires et elle serait transmise par voie orale.
Autres germes en cause
- Les bactéries du groupe HACCEK4
- Des mycètes : surtout Candida albicans mais aussi d’autres Candida et parfois des Aspergillus spp
Tableau 2 : Principales causes de la négativité des hémocultures lors d’endocardite, éléments d’épidémiologie
Le diagnostic des endocardites infectieuses est clinique et microbiologique :
- clinique : présence d’une végétation à l’échocardiographie et symptômes évocateurs ;
- microbiologique : hémocultures positives. D’autres examens bactériologiques sont utiles pour améliorer le diagnostic surtout dans le cas d’hémocultures négatives : sérologie, culture du sang sur milieu cellulaire, PCR sur sérum enfin étude microbiologique et anatomopathologique des valves cardiaques.
Il est donc utile que le biologiste soit averti de la suspicion d’endocardite chez le patient afin de mettre en œuvre les techniques les plus adaptées.
Hémocultures
Dans cette page est seulement décrit ce qui est particulier au diagnostic des endocardites ; ce qui est en commun avec le diagnostic des autres bactériémies est présentée à la page Diagnostic au laboratoire des bactériémies
Les hémocultures permettent d’isoler le micro-organisme responsable de l’endocardite dans plus de 90 % des cas.
Prélèvement
Les recommandations sur le prélèvement sont différentes de celles préconisées pour l’étude des autres bactériémies.
- Avant toute prise d’antibiotiques, il faut effectuer une série de 3 hémocultures (3 paires de flacons aérobie et anaérobie) espacées d’au moins 1 heure sur une durée totale de 24 heures. Le moment du prélèvement ne dépend pas de la température du patient puisque la bactériémie est constante lors d’une endocardite infectieuse.
- Si ces hémocultures sont négatives après 48 à 72 h d’incubation une autre série est réalisée et une possible endocardite infectieuse à hémoculture négative est suspectée.
Le choix des milieux et/ou de la technique de prélèvement est important et peut être différent pour la 2ème série :
- Privilégier des milieux contenant des inhibiteurs d’antibiotiques puisque c’est la 1ère cause de négativité des hémocultures : charbon, résines ;
- Prélever sur IsolatorTM : ce système de lyse-concentration est très performant pour isoler notamment des germes intracellulaires ;
- Rajouter des milieux spécifiques pour les mycètes.
Durée d’incubation
La majorité des germes cultivent en quelques jours, mais il faut parfois un temps plus long pour isoler des microorganismes à croissance lente et/ou difficile. Il est donc indispensable d’incuber les flacons à 37°C pendant au moins 15 jours et jusqu’à 1 mois.
Autres examens utiles en cas de suspicion d’endocardite infectieuse à hémoculture négative
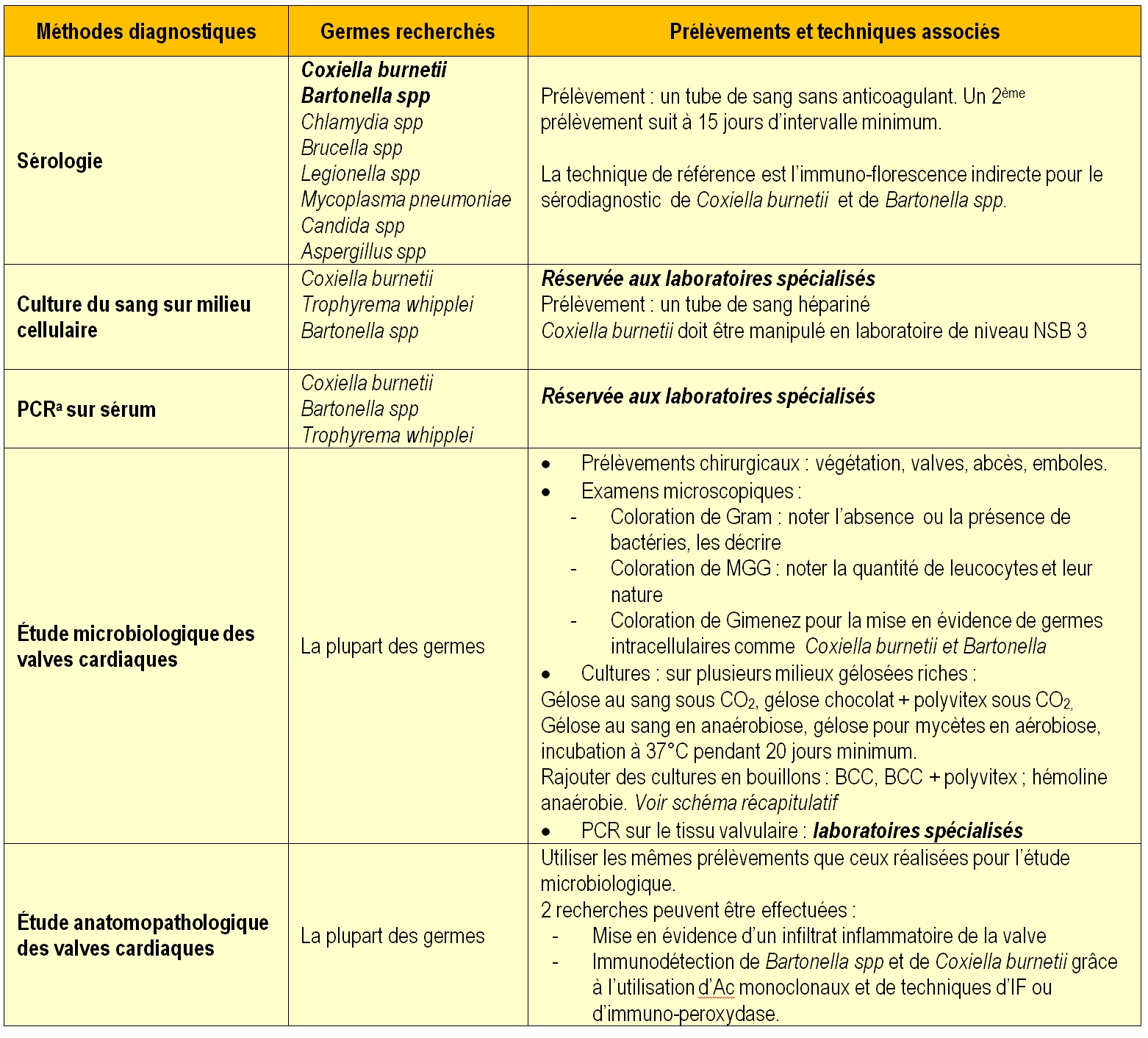
Lorsque la présomption d’endocardite est forte, et si les hémocultures restent négatives, le biologiste doit recourir à d’autres méthodes pour rechercher les agents étiologiques. Le tableau 3 résume ces méthodes ; la sérologie est l’examen le plus fréquemment utilisé en routine.
Tableau 3 : Principales méthodes utilisées pour le diagnostic des endocardites infectieuses à hémoculture négative
a La biologie moléculaire est un outil conseillé en cas d’hémoculture négative mais reste une technique réservée à certains laboratoires seulement. Une amplification génique suivie d’une analyse des données de séquençage peut être réalisée soit sur le sérum soit sur le tissu valvulaire. Plusieurs amplifications sont possibles :
- PCR bactérienne universelle sur tissu valvulaire : recherche du gène codant pour l’ADN ribosomique16S. Une amplification positive par ce test permet d’affirmer l’étiologie bactérienne de l’endocardite infectieuse
- PCR fongique universelle sur tissu valvulaire : recherche du gène codant pour l’ADN ribosomique 18S. Effectué en 2ème intention quand la PCR 16S est négative ce test met en évidence la présence de mycètes (levures ou champignons filamenteux)
- PCR spécifique sur tissu valvulaire ou sérum : recherche ciblée de Bartonella spp, C. burnetii, T. whipplei en fonction du contexte clinique et/ou épidémiologique
Interprétation des résultats
Le diagnostic d’endocardite infectieuse repose sur la conjonction de données cliniques et microbiologiques.
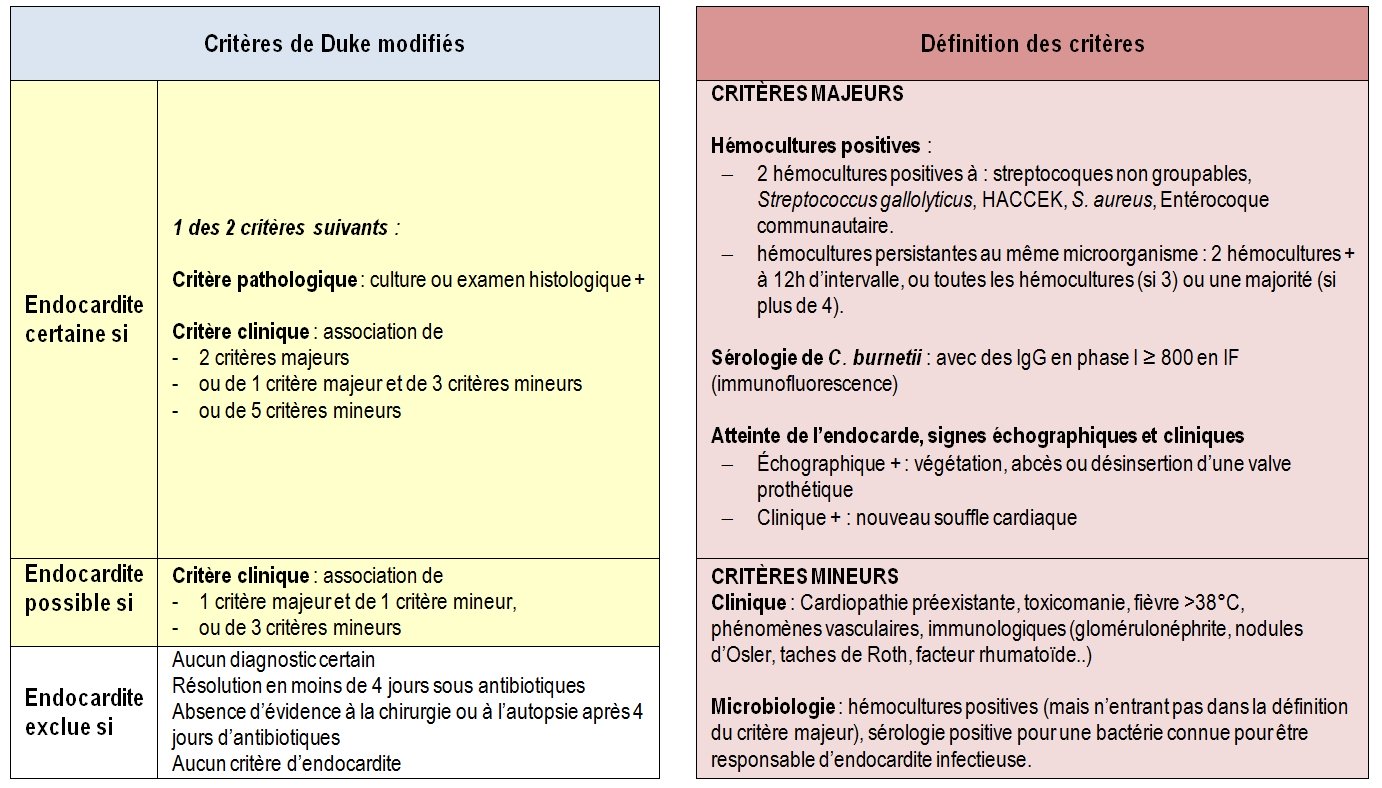
Il existe une classification internationale (critères de Duke modifiés par Li et al.) permettant de classer le diagnostic en certain, possible ou exclu selon la présence ou non de critères majeurs ou mineurs.
Tableau 4 : Critères de Duke modifiés pour le diagnostic d’une endocardite infectieuse