La coproculture est une étape de l’examen microbiologique des selles. Elle correspond à l’ensemencement de milieux généralement sélectifs pour isoler puis identifier l’agent infectieux.
PLAN
- CONTEXTES
- PRÉLÈVEMENTS DES SELLES
- DIFFÉRENTS TEMPS DE L’ANALYSE
- APPORT DE LA BIOLOGIE MOLÉCULAIRE AU DIAGNOSTIC DES INFECTIONS INTESTINALES
- COPROCULTURE STANDARD
- Salmonella et des Shigella
- Campylobacter
- Yersinia
- COPROCULTURE COMPLÉMENTAIRE
- EPEC
- EHEC
- ETEC et des EIEC
- Vibrio cholerae
- Vibrio non cholerae, Aeromonas et Proteus shigelloides
- Microorganismes responsables des diarrhées post-antibiotiques
- Virus
- Parasites
- COPROCULTURE HORS CONTEXTE D’INFECTION INTESTINALE
CONTEXTES
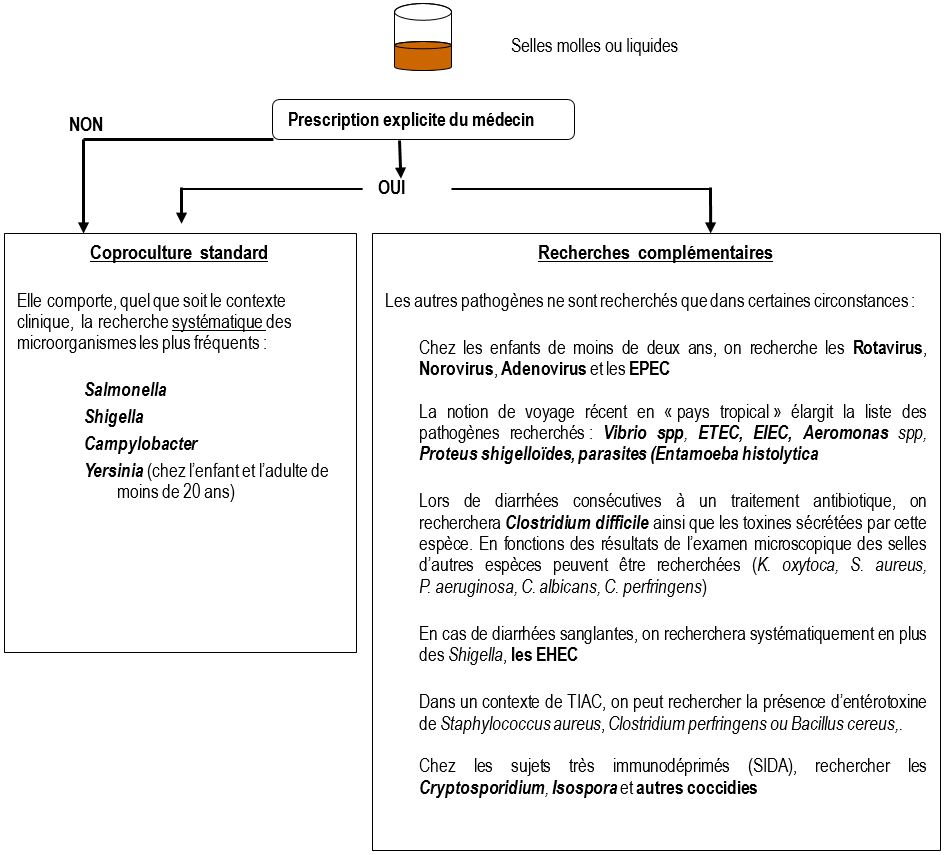
Il existe principalement 4 contextes justifiant un examen microbiologique des selles :
- Déterminer l’étiologie d’une diarrhée
- Détecter les porteurs sains de bactéries entéropathogènes. Cet examen a longtemps été pratiqué systématiquement pour le personnel des services de restauration et de l’industrie agro-alimentaire. Désormais, il semble se limiter à des contextes particuliers (personnel de retour de voyage par exemple)
- Détecter les porteurs asymptomatiques de bactéries multirésistantes aux antibiotiques à l’hôpital.
- Surveiller les flores de certains sujets immunodéprimés comme les patients aplasiques des services d’onco-hématologie. En raison de leur pathologie, ces patients subissent une décontamination digestive afin de réduire quantitativement une partie de leur flore intestinale. Ainsi cette coproculture quantitative sert à vérifier que l’objectif est atteint.
Déterminer l’étiologie d’une diarrhée
Pour des raisons d’efficacité et de coût, le laboratoire ne recherche pas systématiquement la totalité des agents susceptibles d’être entéropathogènes. Par conséquent, il est nécessaire d’organiser les investigations en fonction du contexte clinique et épidémiologique :
- type de diarrhée : inflammatoire ou hydrique ;
- symptômes associés : douleurs abdominales, vomissements, sang dans les selles, fièvre, altération de l’état général ;
- âge du malade ;
- origine géographique ou la notion de voyage récent ;
- antibiothérapie récente ;
- immunodépression ;
- autres cas dans l’entourage
PRÉLÈVEMENT DES SELLES
Le prélèvement s’effectue de préférence au laboratoire. Le patient transfère l’équivalent d’une noix de selles, à l’aide d’une spatule ou d’un flacon-cuillère, dans un pot stérile en privilégiant les éléments glaireux, sanglants ou d’aspect atypique.

Chez le nourrisson et le petit enfant, on peut réaliser un écouvillonnage rectal.
Afin d’éviter la dessiccation et la prolifération des bactéries et levures commensale, il faut analyser les selles dans les 2 heures qui suivent leur recueil. Sinon on peut les conserver 12 h maximum à 4°C
Au-delà de ce délai, un système de transport comme le dispositif COPAN fecal swab est nécessaire. Il est composé d’un écouvillon et d’un milieu de transport Cary-Blair (milieu contenant du thioglycolate de sodium et un tampon phosphate).

DIFFÉRENTS TEMPS DE L’ANALYSE
Les différentes étapes de l’analyse sont les suivantes :
- Examen macroscopique des selles
- Examen microscopiques des selles
- Coproculture = mise en culture des selles
- Éventuellement utilisation de tests rapides :
- mise en évidence de certains agents infectieux ou de leur toxine par des méthodes immunochromatographqiues ou immunoenzymatiques
- mise en évidence de gènes présents seulement présents chez certains microorganismes pathogènes (voir le chapitre sur l’apport des techniques moléculaires)
- Étude de la sensibilité aux antibiotiques pour certaines espèces ou selon le contexte
Examen macroscopique des selles
On notera la consistance (liquides, molles, moulées), la présence de glaires, de pus et de sang.
Examens microscopiques des selles
État frais
Faire une suspension homogène de la selle dans l’eau physiologique et examiner entre lame et lamelle à l’objectif X40. À ce propos, la dilution doit être suffisante pour apprécier la mobilité des bactéries mais pas trop forte sinon les recherches sont plus longues.
Ensuite, prélever si possible dans une zone muco-purulente ou sanglante.
Il permet :
- la recherche des leucocytes fécaux. Leur présence témoigne d’une inflammation du tube digestif et oriente vers une infection à microorganismes invasifs (Salmonella, Shigella, Yersinia, Campylobacter). En revanche, on n’en trouve pas dans le cas de diarrhées à microorganismes entérotoxiques ou à virus.
- de repérer des Vibrio et des Campylobacter grâce à leur mobilité par ciliature polaire en « vol de moucheron »
- de rechercher les hématies, les levures.
Il faut souligner que cet examen manque de sensibilité et présente une valeur seulement s’il est positif.
Dans le cas où des leucocytes, des hématies et des levures sont observés, il faut préciser leur nombre par champ.
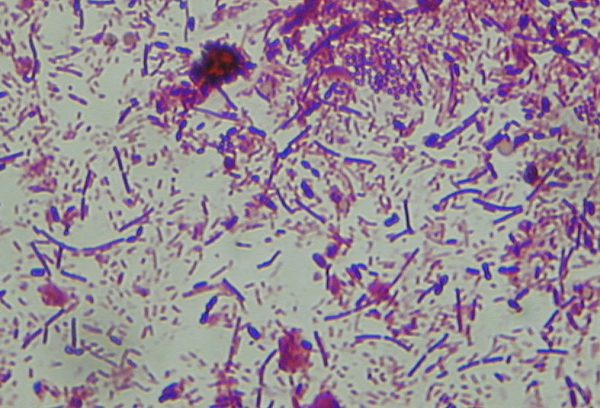
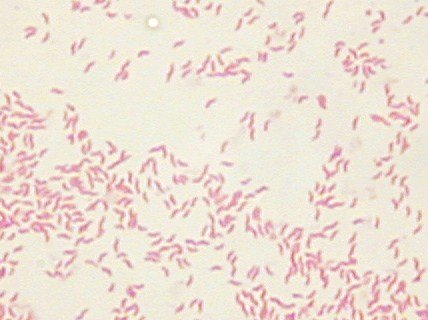
Frottis des selles coloré au Gram
Premièrement, il s’agit d’apprécier l’équilibre de la flore en déterminant les % de bactéries Gram + et Gram -. En règle générale, les Gram + représentent entre 20 et 30% et les Gram – entre 70 et 80%. Ces pourcentages sont en partie liés aux habitudes alimentaires.
En revanche, un fort déséquilibre (> 90%) correspond très souvent à la colonisation par un microorganisme pathogène.
À noter que la description précise des bactéries observées est seulement utile s’il y a un fort déséquilibre de la flore.
Enfin, cet examen permet également de rechercher des bactéries présentant une morphologie particulière tels les Campylobacter.
Frottis de selles après coloration de Gram (X1000)
© Pascal Fraperie
Coproculture
La coproculture correspond à l’ensemencement de milieux généralement sélectifs pour isoler puis identifier l’agent infectieux. De plus en plus nombreux, les milieux chromogènes sélectifs de dernière génération ont grandement facilité le repérage des agents infectieux présents au sein d’une flore commensale riche et variée.
À noter que pour certains germes la recherche se fait après une phase d’enrichissement.
APPORT DE LA BIOLOGIE MOLÉCULAIRE AU DIAGNOSTIC DES INFECTIONS INTESTINALES
La recherche de microorganismes entéropathogènes par PCR multiplex est en plein essor. Elle présente de multiples avantages par rapport à la recherche par coproculture :
- Une meilleure sensibilité
- La recherche simultanée d’un plus grand nombre de souches entéropathogènes
- Un rendu des résultats plus rapide : 2h au lieu de 48h/72h
- Un temps technicien bien plus faible
Son principal inconvénient actuellement est son coût.
Les laboratoires qui utilisent ces méthodes ont considérablement réduit le nombre de selles mises en culture. En effet la mise en culture se limitent aux selles pour lesquelles les tests moléculaires sont positifs. En outre seuls les milieux correspondants au pathogène détecté sont ensemencés.
Les méthodes actuellement disponibles sont variées, vous en trouverez à cette adresse : https://collegebvh.org/system/files/fichiers/document/fichiers/a1-diagnostic_rapide_des_salmonelles-shigelles-campylobacter_gibaud.pdf
COPROCULTURE STANDARD
BCP = gélose lactosée au pourpre de bromocrésol
Campylo = milieu d’isolement sélectif des Campylobacter (Campylosel, Karmali..)
Chromo = gélose chromogène Salmonella,
GS = gélose au sang
RECHERCHE DES SALMONELLA ET SHIGELLA
Premier jour
Ensemencer un milieu d’enrichissement en Salmonella
Pour commencer, notons qu’il n’existe pas de milieu d’enrichissement en Shigella
Compte tenu que les Salmonella sont souvent en petite quantité dans les selles, on ensemence dès le premier jour, un milieu d’enrichissement. C’est un milieu sélectif liquide dans lequel les Salmonella se multiplient plus rapidement que les microorganismes commensaux du fait de la présence d’agents inhibiteurs.
On peut utiliser l’un des milieux suivants :
- Rappaport (chlorure de magnésium à 30 g/L, vert de malachite, pH à 5.5) à incuber à 37°C pendant 24h ;
- Rappaport -VASSILIADIS à teneur réduite en vert malachite et à incuber à 41°C pendant 24h ;
- Milieu au sélénite de sodium, 3 à 6 heures à 37 °C ;
- Muller Kauffman (vert brillant) 3 à 6 heures à 37 °C ;
- Milieu tétrathionate-novobiocine (vert brillant, novobiocine) à 37°C.
On ensemence ces milieux avec 5 gouttes de la suspension préparée pour l’état frais.
Le lendemain, on ensemence avec la culture obtenue, un milieu d’isolement sélectif des Salmonella (SS, Hektoen, SM2 ou Rambach).
Ensemencer un milieu d’isolement sélectif
Pour obtenir suffisamment de colonies isolées de Salmonella ou de Shigella, il faut déposer un inoculum dense (par exemple la suspension préparée pour l’état frais) et l’épuiser au maximum en réalisant des stries serrées.
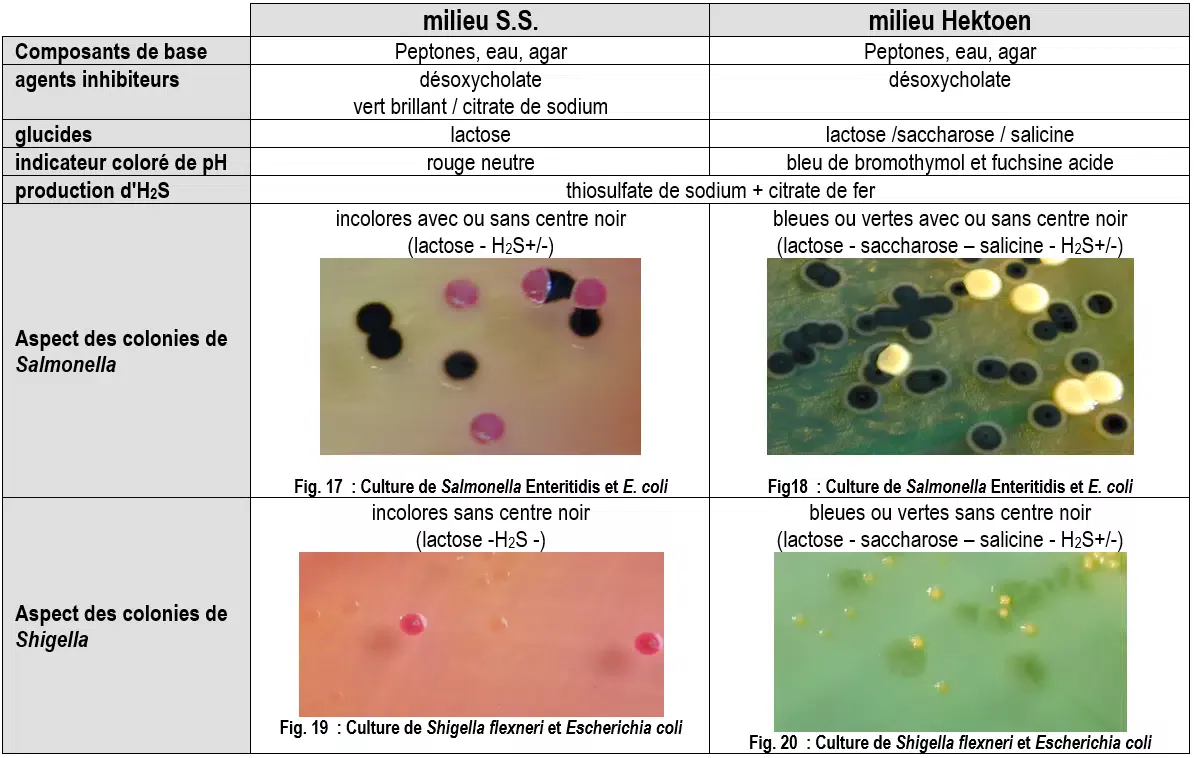
Les milieux d’isolements classiques (conviennent pour Salmonella et Shigella)
Ces milieux sélectifs inhibent totalement la culture des Gram + et partiellement celle des Gram -. Les milieux les plus satisfaisants sont les suivants :
- milieu S.S (Salmonella – Shigella) : permet la croissance des Salmonella et plus difficilement celle des Shigella
- milieu Hektoen : milieu qui permet en particulier une très bonne culture des Shigella. Ce milieu contient trois glucides, ce qui augmente son caractère discriminant. Les Salmonella et les Shigella n’utilisent aucun de ces glucides.
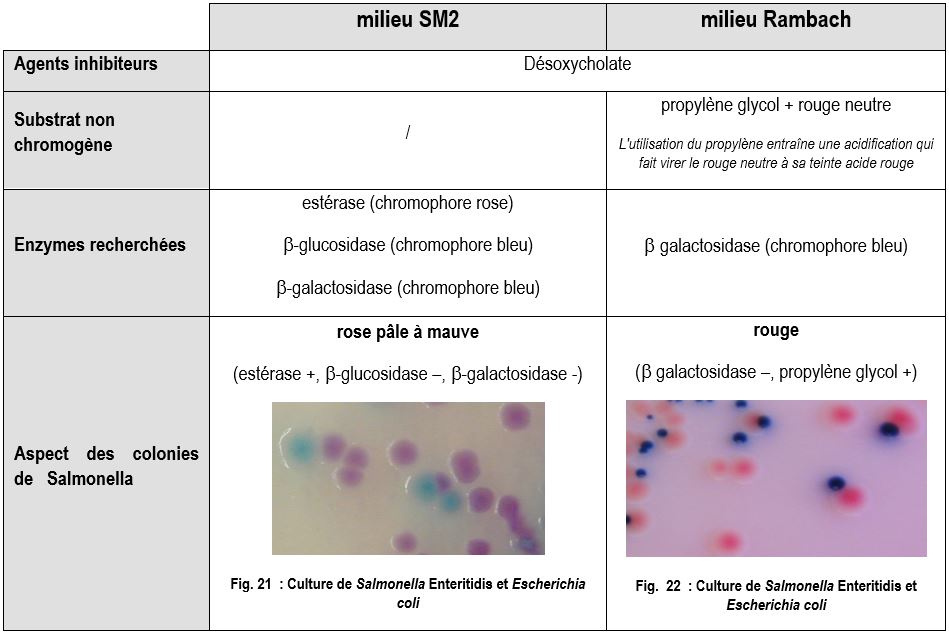
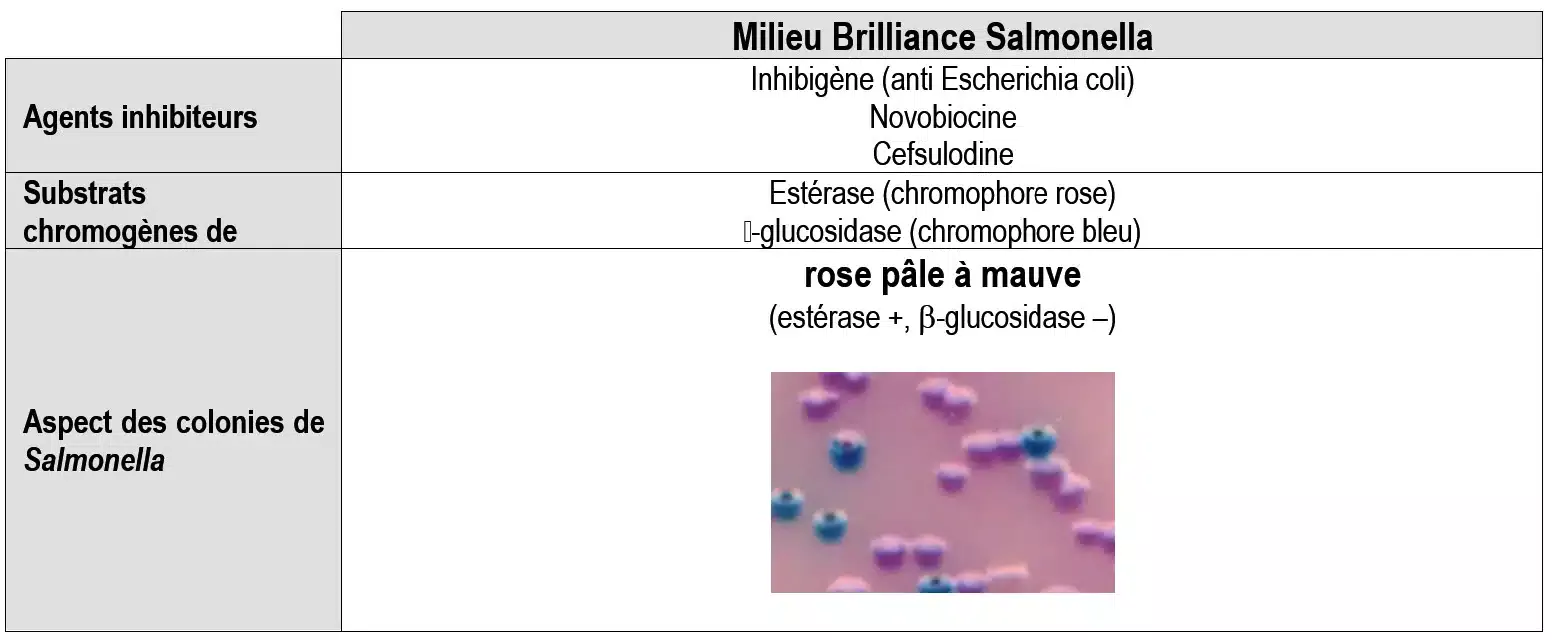
Les milieux d’isolement sélectifs chromogènes (uniquement pour Salmonella)
Exemples : Gélose chromID™ Salmonella SM2 (Biomérieux) et milieu Rambach (Merck).
Ces milieux contiennent des inhibiteurs de la flore Gram + (désoxycholate) ainsi que des substrats liés à un chromogène. Lorsque le microorganisme possède l’enzyme capable d’hydrolyser le substrat, un chromophore est libéré et colore spécifiquement la colonie. Désormais, ces milieux permettent d’identifier avec une quasi-certitude les Salmonella. Cependant il persiste un risque de faux positifs ou de faux négatifs. En règle générale, on les utilise lors du repiquage du bouillon d’enrichissement.
Sont apparus récemment des milieux sélectifs utilisant une nouvelle stratégie pour inhiber la croissance de certains. C’est le cas de la gélose Brilliance Salmonella produite par Oxoid.
Cette gélose contient une molécule appelée « inhibigène ». Cette molécule est constituée d’un inhibiteur couplé à un autre élément par une liaison qui ne peut être clivée que par une enzyme spécifique. L’inhibiteur n’a pas d’activité inhibitrice tant qu’il est couplé. Une fois que l’inhibigène pénètre dans la cellule, la liaison sera clivée si la bactérie possède l’enzyme capable de le faire. Alors, l’inhibiteur devient actif et interrompt la synthèse de la paroi cellulaire, provoquant la mort de la bactérie.
Comme l’inhibiteur libéré ensuite dans le milieu n’est pas capable de pénétrer dans d’autres bactéries, l’inhibition demeure ciblée. L’inhibigène présent dans l’agar Brilliance Salmonella a été conçu pour inhiber Escherichia coli.
La novobiocine et la cefsulodine, présentées sous forme d’un supplément lyophilisé (SR0194), sont ajoutées au milieu afin d’inhiber la croissance de la flore compétitrice comme Proteus spp. et Pseudomonas spp.
Deuxième jour
Isoler sur un milieu sélectif, le bouillon d’enrichissement en Salmonella
De nombreux laboratoires ensemencent les milieux chromogènes (Rambach ou SMID2) seulement après l’étape d’enrichissement.
Remarque : inutile de faire un examen macroscopique et microscopique de ce bouillon.
Repérer les colonies suspectes sur le milieu sélectif ensemencé
Sur milieu SS
Des bactéries autres que les Salmonella ou Shigella et appartenant à la flore commensale peuvent présenter le même aspect sur SS :
- Proteus mirabilis et vulgaris, et certains Citrobacter sont aussi lactose -, H2S+ et forment des colonies semblables au Salmonella H2S +.
- Pseudomonas (mais ils sont oxydase +), Providencia, Morganella morganii, certains biotypes d’E. coli, Hafnia alvei, et les Serratia sont lactose -, H2S – et forment des colonies semblables au Salmonella H2S – et Shigella.
Sur milieu Hektoen
Le milieu Hektoen est plus discriminant que le milieu SS car la plupart des espèces, précédemment citées, pouvant être confondues avec les Salmonella et les Shigella utilisent généralement le saccharose et/ou la salicine et forment donc des colonies saumons, bien distinctes de celles des Salmonella et Shigella.
Cependant P. mirabilis n’utilisent pas les glucides de la gélose Hektoen et forment des colonies semblables aux Salmonella H2S +.
Sur Rambach ou SM2
Les colonies suspectes d’être des Salmonella sont des colonies rouges pour Rambach et mauve à rose pâle pour SMID2. (Voir page précédente). Ces milieux sont très discriminants, ainsi la probabilité que ces colonies suspectes soient des Salmonella est très élevée.
Identification des colonies suspectes
La démarche d’identification des colonies suspectes dépend des milieux d’isolements choisis pour repérer les Salmonella/Shigella et des méthodes d’identification employées.
Pour éviter d’ensemencer une galerie d’identification avec une colonie suspecte sur SS et Hektoen qui ne serait ni une Salmonella ni une Shigella, des tests préalables sont recommandés.
Les milieux chromogènes sont eux beaucoup plus performants pour différentier les Salmonella des autres germes, la galerie d’identification sera ensemencée sans tests préalables.
Enfin si l’identification est faite par spectrométrie de masse MALDI-TOF, il est possible, étant donné la rapidité du résultat, de tester une nouvelle colonie si la première n’est pas une Salmonella. Dans ce cas, les tests préalables ne sont donc pas nécessaires.
Afin de ne pas rendre de résultats faussement négatifs, on considèrera qu’il n’y a pas de Salmonella ou de Shigella seulement après avoir testé au moins cinq colonies suspectes.
Démarche d’identification des colonies suspectes sur SS ou Hektoen
Réaliser un test oxydase sur les colonies suspectes H2S – afin d’écarter d’éventuels Pseudomonas.
Réaliser le test de l’uréase rapide sur les colonies suspectes
Ce test, peu onéreux et rapide, permet d’éliminer les Proteus (les Salmonella et Shigella sont uréase – et les Proteus sont uréase +). Il est nécessaire de pratiquer cette recherche sur 5 colonies pour éviter de rendre un résultat faussement négatif dans le cas où les selles contiendraient à la fois des Salmonella et des Proteus.
Dans 5 tubes à hémolyse on place 3 gouttes d’urée-tryptophane et on introduit dans chacun une colonie suspecte.
Les tubes sont placés à l’étuve à 37°C avec un témoin Proteus. On considère le résultat négatif, si le milieu est toujours jaune-orangé, 30 minutes après le virage du témoin Proteus et après 4 heures d’incubation.
Poursuivre l’analyse des colonies uréase –
Il s’agit ensuite de poursuivre l’analyse avec toutes les suspensions en milieu urée-tryptophane « uréase négative ».
La galerie d’identification comprend :
- une galerie API 20E ou une galerie composée des milieux suivants (Kligler, Moeller à la lysine, urée-tryptophane, test ONPG)
- une gélose nutritive en pente (pour faire le sérotypage).
- un isolement sur milieu lactosé comme BCP pour s’assurer de la pureté de la suspension en urée-tryptophane (l’intérêt du lactose est de vérifier que des colonies lactose positive n’ont pas été prélevées malencontreusement ; précaution nécessaire particulièrement lorsque les colonies suspectes étaient mal isolées).
En toute rigueur, il convient de poursuivre l’identification des seules colonies vérifiées « uréase négative ». Dans ces conditions, la galerie d’identification ne peut être ensemencée qu’avec une suspension préparée à partir d’une suspension « uréase négative » et non à partir d’une colonie.
La galerie API 20E sera, par exemple, ensemencée après avoir ajouté 4 mL d’eau distillée stérile à une suspension uréase négative. La présence du rouge de phénol provenant du milieu urée-tryptophane peut donner une teinte rosé au test ONPG.
Il faudrait aussi ensemencer autant de galerie d’identification que de suspensions « uréase négative ». Dans la pratique, quand le choix s’est porté sur la galerie API 20E, une seule suspension « uréase négative » est utilisée.
Démarche d’identification des colonies suspectes sur Rambach ou SM2
Les tests préalables ne sont pas nécessaires.
On se limite alors à l’identification d’une colonie suspecte, par exemple, avec une galerie API 20E et un BCP pour le contrôle pureté.
On prendra soin d’ensemencer une gélose inclinée pour réaliser un sérotypage, le lendemain.
Troisième ou quatrième jour
Apres lecture de la galerie d’identification, si Salmonella spp ou Shigella spp sont identifiées alors il faut impérativement réaliser leur sérotypage (voir dictionnaire des techniques) à partir de la culture sur gélose inclinée.
IMPORTANT : Ne pas donner de résultats négatifs pour la recherche des Salmonella, sans avoir constaté l’absence de colonies suspectes sur le milieu d’isolement ensemencé après enrichissement.
RECHERCHE DE CAMPYLOBACTER
Les Campylobacter doivent être recherchés systématiquement en cas de diarrhée, au même titre que les Salmonella. Leur recherche fait partie de la coproculture standard.
Ces bactéries sont sensibles au dioxygène, les selles sont conservées à +4°C ou acheminées rapidement au laboratoire.
Dans un premier temps sera présentée la démarche classique de recherche des Campylobacter avant de citer quelques tests récents et performants qui permettent désormais de repérer les Campylobacter très rapidement.
Premier jour
Examen direct
A l’état frais, on observe une suspension de la selle au microscope à contraste de phase ou à fond noir (si possible).
C. jejuni se reconnaît par sa morphologie et sa mobilité caractéristique en « vol de moucheron ». Cet examen est d’un grand intérêt dans les cas d’urgence, surtout lorsque les Campylobacter sont abondants, comme c’est le cas en phase aiguë de la maladie.
Après coloration de Gram,
L’aspect est souvent moins évocateur car il est difficile de repérer les Campylobacter (fins bacilles à Gram négatif, incurvés ou en S ou de forme spiralée) au sein d’une flore très variée.
Fig. 23 : Campylobacter en culture pure
GRAM X 100
Culture et isolement
Deux techniques existent et sont complémentaires pour l’isolement sélectif des Campylobacter
L’isolement sur milieu sélectif et l’isolement sélectif par filtration directe. Pour la filtration directe, la limite de détection est plus élevée (il faut une concentration de 105 à 106 Campylobacter par gramme de selle pour avoir une culture positive avec la filtration contre 103 à 104 pour le milieu sélectif) mais présente l’avantage d’assurer la culture de certaines souches de Campylobacter inhibées sur les milieux sélectifs.
Il semble avantageux d’associer ces deux techniques. La technique de filtration semble dans la réalité, très peu utilisée. Le CNR des Campylobacter à Bordeaux l’utilise quand des colonies de Campylobacter sont mal isolées et associées à d’autres colonies bactériennes.
Isolement sur milieu sélectif
L’inoculum doit être riche.
Le milieu de base est un milieu nutritif riche type Mueller Hinton ou Columbia. Il est additionné de sang ou de charbon qui ont pour rôle de neutraliser des substances toxiques produites par le métabolisme bactérien.
Un mélange d’antibiotiques est associé afin d’éliminer les bactéries de la flore fécale.
En France, on utilise principalement deux milieux :
- le milieu de Karmali contenant 0,4% de charbon, de la vancomycine (pour inhiber les Gram positifs), de la céfopérazone (pour inhiber les bactéries Gram négatifs sauf Campylobacter) et actidione (également appelé cycloheximide, pour inhiber les moisissures)
- le milieu Campylosel de bioMérieux : base Columbia enrichie de 5% de sang de mouton et contenant de la vancomycine, de la céfopérazone et l’amphotéricine B
- des milieux chromogènes sélectifs dont la composition exacte n’est pas indiquée (gélose CASA, CHROMagar™ Campylobacter)
Sur ces milieux très sélectifs, certaines souches de Campylobacter cultivent difficilement.
Isolement sélectif par filtration direct
On utilise dans ce cas la propriété des Campylobacter de passer au travers des mailles d’un filtre Millipore™ 0,45µm alors que les autres microorganismes sont retenus.
On réalise une suspension épaisse de la selle dans un bouillon Brucella agar. Une goutte de cette suspension est déposée sur un filtre Millipore 0,45µm en acétate de cellulose, lui-même placé sur un milieu Mueller Hinton à 5% de sang de mouton.
La filtration dure une heure à 37°C. Le filtre est ensuite retiré.

Fig. 24 : Filtration au travers |

Fig. 25 : Culture à l’emplacement |
Conditions d’incubation
Les Campylobacter sont microaérophiles. La concentration optimale en oxygène est de 5 à 6%.
Les milieux sont donc incubés en atmosphère microaérobie contenant 5% d’O2, 10 % de CO2 et 85% d’azote. (Exemple : sachets GENbox microaer de bioMérieux)
C. jejuni et C. coli se développent à 37°C et à 42°C (espèces thermophiles). Les autres Campylobacter moins fréquents dans les selles ne se développent qu’à 37°C.
La sélection des espèces C. jejuni et C. coli coli sur ces milieux est donc favorisée par une incubation à 42°C. Cependant si on souhaite récupérer toutes les espèces de Campylobacter, il est conseillé d’incuber les boites à 37°C.
Les milieux sont incubés 24 à 72 h en atmosphère microaérobie.
Deuxième, troisième jour
Repérage des colonies suspectes
Les Campylobacter donnent de petites colonies luisantes (1 à 2 mm de diamètre), non hémolytiques, grisâtres ou translucides selon les espèces, rondes, lisses, bombées ou plates, ayant tendance à l’envahissement.
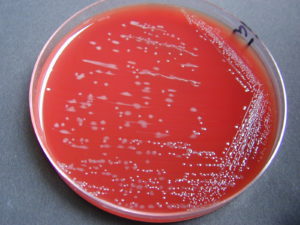
© Pascal Fraperie
Réaliser un Gram, un état frais, un test oxydase
Les Campylobacter sont caractérisés par leur morphologie en « vol de mouette », leur mobilité grâce à une ciliature polaire et un test oxydase +
Identification
- par spectrométrie de masse MALDI-TOF
- ou avec une galerie API Campy (bioMérieux)
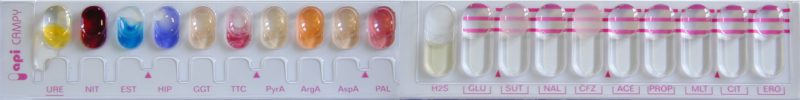
© Pascal Fraperie
- ou avec une galerie d’identification classique comprenant les tests suivants :
- La recherche d’une catalase
- 2 bouillons Brucella : un est placé à 25°C, l’autre à 42°C.
- un milieu Mueller Hinton au sang ensemencé avec une solution d’opacité équivalente à l’étalon 0.5 de Mac Farland et sur lequel on dépose un disque de céfalotine et un disque d’acide nalidixique. Incubation en microaérobiose
- un milieu Mueller Hinton au sang placé en aérobiose pour vérifier l’incapacité à cultiver à l’air : nécessité d’une atmosphère microaérophile
- un test uréase en milieu urée-idole
- La recherche d’une hippuricase
| Recherche de l’hippuricase = test hippurate
Faire une suspension riche de la souche à étudier dans un faible volume de solution d’hippurate de sodium. L’hydrolyse de l’hippurate se traduit par l’apparition d’une coloration violette. L’hippuricase est caractéristique de l’espèce C. jejuni Fig. 27 : Hippuricase + (à gauche) Hippuricase – (à droite) |
Tableau 5 : Quelques caractères différentiels d’espèces de Campylobacter et genre apparenté
L’antibiogramme, selon les recommandations du CA-SFM est réalisé sur milieu MH-F.
Recherche de C. jejuni et C. coli dans les selles par des méthodes immuno-enzymatiques ou par PCR
Des techniques plus rapides et plus sensibles que la culture sont disponibles depuis le début des années 2010 comme :
- Des tests ELISA : Ridascreen Campylobacter (r-biopharm®), premier Campy (Méridian®)
- Un test immunochromatographique unitaire : Immunocard Stat ! Campy (Méridian®).
La différenciation des espèces est désormais possible par spectrométrie de masse MALDI-TOF ou PCR multiplex.
RECHERCHE DE YERSINIA
Les Yersinia ont la particularité se développer plus lentement que les autres entérobactéries et d’avoir une température optimale de croissance inférieure (28°C au lieu de 37°C). Dans un produit polymicrobien comme les selles et dans les conditions de culture classiques (24h à 37°C), ces bactéries sont le plus souvent masquées par la flore digestive. L’utilisation systématique d’un milieu sélectif incubé à 28°C a permis d’améliorer leur repérage.
Premier jour
L’enrichissement en Yersinia est rarement pratiqué. Il existe deux possibilités pour le réaliser :
- ensemencer un bouillon contenant du vert de Malachite et de la carbénicilline ;
- ensemencer un bouillon nutritif et l’incuber à 4°C pendant 3 semaines (on utilise le caractère psychrophile des Yersinia pour augmenter leur proportion).
De nombreux laboratoires se limitent à l’ensemencement d’un milieu sélectif approprié : le milieu Yersinia CIN.
Sa sélectivité élevée permet d’inhiber la presque totalité de la flore associée (désoxycholate, cristal violet, irgasan, cefsulodine et novobiocine). La présence de mannitol et de rouge neutre facilite le repérage des colonies et permet une orientation présomptive de Y. enterocolitica.
Après ensemencement, le milieu est incubé entre 28 et 30°C (température optimale de croissance des Yersinia).
D’après le BEH n° 29 du 13 juillet 2010, les techniques d’enrichissement n’améliorent pas de façon notable le taux d’isolement des Yersinia pathogènes.
Ce milieu ne permet cependant pas la croissance de toutes les Yersinia entéropathogènes, et de plus il inhibe certaines souches de Y. pseudotuberculosis.
Deuxième jour
Après 24 h d’incubation, les colonies de Yersinia apparaissent petites (1 mm de diamètre) translucides à centre rouge ou entièrement rouges (mannitol +). La taille des colonies est supérieure après 48 h d’incubation.
Remarque : malgré la sélectivité élevée de ce milieu, certaines souches, par exemple de Citrobacter et d’Enterobacter, peuvent cultiver sur ce milieu cependant elles forment après 24h d’incubation des colonies rouges plus grosses (2 à 3 mm) que celles des Yersinia (1 mm).
 Fig. 28 : Y. enterocolitica sur CIN après 24H à 30°C Fig. 28 : Y. enterocolitica sur CIN après 24H à 30°C© Pascal Fraperie |
 Fig. 29 : Y. enterocolitica sur CIN après 48H à 30°C Fig. 29 : Y. enterocolitica sur CIN après 48H à 30°C© Pascal Fraperie |
L’intérêt d’un test uréase rapide est discutable. S’il est positif, il conforte une orientation vers l’espèce Yersinia enterocolitica mais s’il est négatif, il ne permet pas d’exclure pour autant cette espèce.
L’identification des colonies suspectes peut être réalisée sur API 20 E.
La galerie est ensemencée directement avec les colonies suspectes. Bien que certains caractères métaboliques des Yersinia s’expriment mieux à 30°C, afin d’utiliser la base de données de la galerie API 20E, cette dernière sera incubée à 37°C.
Troisième jour
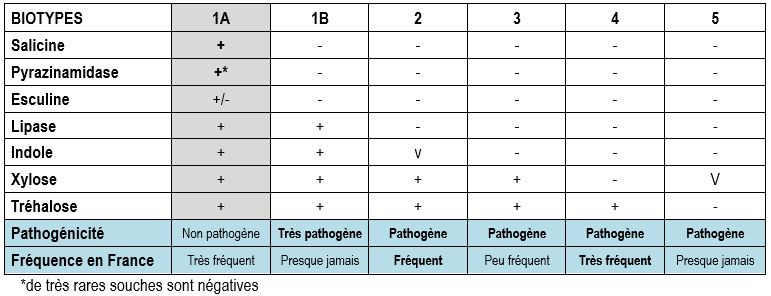
Si une souche de Yersinia enterocolitica est identifiée, il faut l’envoyer au CNR afin que soit réalisé un biotypage, un sérotypage et un lysotypage. Le biotypage permet de déterminer si la souche appartient à un biotype pathogène, en effet les biotypes 1B, 2, 3, 4 et 5 sont entéropathogènes alors que les souches du biotype 1A sont considérées comme non pathogènes.
Le tableau 6 rassemble les principaux tests utiles pour différencier les 6 biotypes de Y. enterocolitica.
Tableau 6 : Caractérisation des différents biotypes
Le sérotypage des souches, réalisé par le CNR est complémentaire car il existe une forte corrélation entre biotypes pathogènes et sérotypes : le biotype 4 est toujours associé au sérotype O:3, le biotype 2 aux sérotypes O:9, O:5,27 et le biotype 3 aux sérotypes O:5,27 et O:3.
Pour l’instant, le diagnostic moléculaire manque de sensibilité et de spécificité pour remplacer la recherche par culture.
La détermination du biotype des souches de Yersinia pseudotuberculosis n’est pas utile car toutes les souches de cette espèce sont entéropathogènes.
COPROCULTURE COMPLÉMENTAIRE
Elle est réalisée en cas d’échec de la coproculture standard.
C’est sur prescription explicite du médecin que le laboratoire peut être amené à rechercher des microorganismes moins courants correspondants à des contextes cliniques particuliers.
Recherche des EPEC
La recherche des EPEC est réalisée uniquement sur les selles d’enfants de moins de 2 ans.
Le gram montre souvent une monoflore de bacilles Gram négatifs très caractéristique.
Les selles diluées sont ensemencées sur milieu BCP (ce milieu non sélectif permettra d’apprécier l’abondance des colonies suspectes par rapport à la flore commensale). On peut associer un isolement sur Drigalski, Mac Conkey ou EMB.
Le lendemain, on recherche les colonies suspectes qui sont des colonies lactose +, en grand nombre, puis on vérifie ensuite que ces colonies suspectes sont bien des E. coli en étudiant leurs caractères biochimiques (par une galerie API 20E par exemple).
Identification par sérotypage
Le sérotypage a longtemps été le seul moyen pour identifier les EPEC.
Il se fait par réaction d’agglutination sur lame avec des sérums correspondants aux sérotypes entéropathogènes.
Après avoir vérifié la non-autoagglutinabilité de la souche, il faut tester le sérum nonavalent et en cas de négativité le sérum trivalent IV.
En cas d’agglutination avec un de ces sérums, le sérogroupage est poursuivi.
Identification par la mise en évidence du gène eae par PCR
Aujourd’hui, le sérotypage n’est plus recommandé car la corrélation entre sérotype et pouvoir pathogène n’est que partielle.
Désormais, le diagnostic repose sur la mise en évidence du gène eae par PCR à partir d’une culture sur gélose ensemencée pour la coproculture.
Remarque : on ne pourra donner un résultat négatif qu’après avoir testé 5 colonies différentes.
Recherche des EHEC
La recherche des EHEC se justifie chez des malades présentant une diarrhée d’abord liquide puis sanglante et impérativement en cas de SHU (syndrome hémolytique et urémique).
Habituellement, la diarrhée apparait 2 à 3 jours après la consommation de viande de bœuf insuffisamment cuite (contamination la plus fréquente en France).
Les EHEC isolés appartiennent dans environ 80% des cas au sérotype O157 H7.
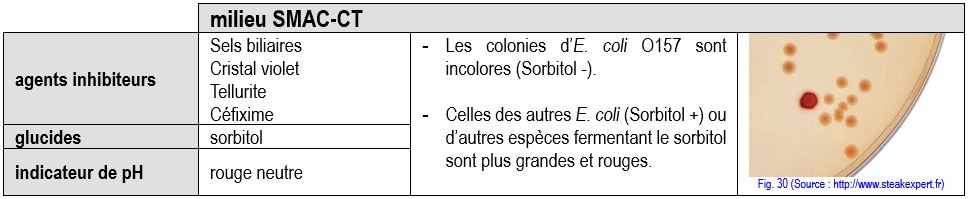
Les souches d’Escherichia coli O157 se différencient des autres E. coli par :
- une absence de fermentation du sorbitol
- une absence de ß glucuronidase
Un des premiers milieux mis au point pour leur isolement est la gélose SMAC : une gélose Mac Conkey dont le lactose est remplacé par du sorbitol. Le milieu SMAC–CT (Céfixime, tellurite) plus sélectif, inhibe mieux la flore commensale.
Remarque : Les STEC non O157 ne sont pas repérés sur ce milieu puisque ces souches sont sorbitol +.
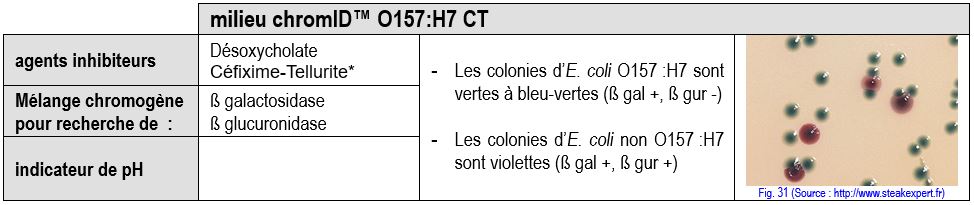
Milieux chromogènes
Plus récemment sont apparues des milieux chromogènes beaucoup plus performants comme le milieu O157H7 ID de bioMérieux qui est un milieu chromogène sélectif permettant la détection de deux activités enzymatiques :
- la ß D-galactosidase présente chez les souches d’Escherichia coli quel que soit leur sérotype.
- la ß D-glucuronidase, présente chez les souches d’Escherichia coli mises à part les O157:H7.
* le milieu chromID O157:H7, peut être additionné du mélange Céfixime-Tellurite (CT), il est alors plus sélectif des Entérobactéries
Pour conclure à un EHEC O157, il faut :
- Identifier l’espèce E. coli avec une galerie adaptée
- Mettre en évidence l’antigène O157 à l’aide de particules de latex sensibilisées par des anticorps anti O157
- Mettre en évidence l’antigène H7 avec un sérum anti H7.
Depuis peu, il est possible d’identifier les EHEC par de nouvelles méthodes :
- la recherche des gènes stx1 et stx2 après amplification génique à partir des selles ou d’une culture de 24h. Ces tests ont pour avantage de permettre l’identification des EHEC non O157 H7. Le test GenoType® EHEC est présenté en annexe 1.
- La recherche par un test immunochromatographique des deux Shiga-like toxine
Exemple : ImmunoCard STAT!® EHEC (Méridian®) http://www.meridianbioscience.com/diagnostic-products/foodborne/immunocard-stat/immunocard-stat-ehec.aspx
Recherche des ETEC et des EIEC
Les ETEC et les EIEC sont rares en France, seuls des laboratoires spécialisés les recherche.
Ils utilisent des techniques de biologie moléculaire qui consistent à mettre en évidence les gènes codant les facteurs de pathogénicité et qui caractérisent chaque pathovar.
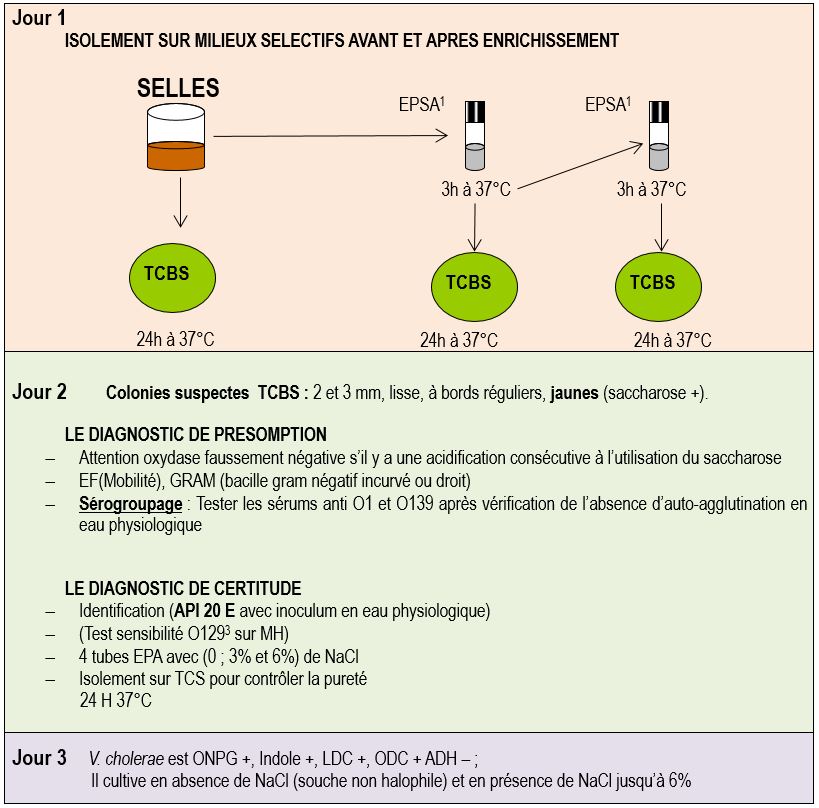
Recherche de Vibrio cholerae
En France, on recherche Vibrio cholerae chez les malades présentant une diarrhée au retour d’un voyage en Afrique, Asie ou Amérique latine. Les selles des patients atteints de choléra sont fécaloïdes pendant les premières heures de la maladie puis liquides et dans les cas extrêmes aqueuses avec des grains riziformes. La recherche peut aussi être effectuée à partir des vomissements du patient.
V. cholerae étant sensible à la dessiccation et au froid, il faut placer le prélèvement dans un milieu de transport ou dans un tube plastique avec quelques gouttes de sérum physiologique et est toujours conservé à température ambiante (ne jamais réfrigérer ou congeler).
Premier jour
-
L’examen direct est le plus souvent caractéristique
- GRAM : bouleversement de la flore = très fort déséquilibre avec de très nombreux bacilles Gram négatif incurvés (ou non);
- EF : présence de mucus et de bacilles très mobiles à l’état frais (ciliature polaire) ; absence de leucocytes.
-
A partir des selles, on réalise un isolement sur milieu TCBS (Thiosulfate-Citrate-Bile-Saccharose)
Remarque : il existe un milieu chromogène commercialisé par bioMérieux (gélose chromID™ Vibrio) qui permet l’identification présomptive de V. cholerae.
- Chez les sujets porteurs sains ou présentant une forme atténuée de choléra, les Vibrio cholerae sont présents en petite quantité dans les selles. Il est dès lors nécessaire d’enrichir les selles en V. cholerae. L’enrichissement s’obtient en ensemençant une eau peptonée salée alcaline (pH=9). La forte concentration en NaCl (30 g/L) et le pH alcalin de ce milieu donne un avantage sélectif à la plupart des espèces de vibrions halophiles ou halotolérants en favorisant leur croissance par rapport à d’autres micro-organismes présents habituellement dans les selles.
L’incubation de l’eau peptonée alcaline ne doit pas dépasser 6 heures, car au-delà la multiplication des bactéries associées aux Vibrio diminuerait l’efficacité de l’enrichissement.
Deuxième jour
- Il est important de déterminer rapidement si les colonies suspectes sont celles de l’agent du choléra (donc d’une souche de V. cholerae O1 ou O139) afin d’alerter immédiatement les autorités sanitaires. La stratégie consiste donc à effectuer un diagnostic rapide de présomption à partir des colonies suspectes sur les milieux d’isolement :
Dans un contexte épidémiologique de choléra, les colonies saccharose + (sur TCBS) correspondants à des bacilles gram négatif (incurvés ou non), qui agglutinent dans le sérum anti-O1 ou anti-O139 sont très probablement l’agent du choléra.
Une déclaration de présomption de choléra est adressée aux autorités sanitaires nationales et la souche envoyée au LNR (laboratoire national de référence) pour confirmation du diagnostic.
En parallèle de cet envoi le LBM vérifie que la souche isolée appartient bien à l’espèce Vibrio cholerae en ensemençant une galerie Api 20E et en recherchant la croissance à différentes concentrations en NaCl (0 ; 3% et 6%).
Remarque : la galerie API 20E comprend davantage de caractères utiles à l’identification des Vibrio, elle est préférable à la galerie API20NE. Comme certains Vibrio sont halophiles, on prépare l’inoculum en eau physiologique.
Troisième jour
- V. cholerae est ONPG +, Indole +, LDC +, ODC + ADH – ; il cultive en absence de NaCl (souche non halophile) et en présence de NaCl jusqu’à 6% (souche halotolérante).
- La détermination du biotype (classique ou El Tor), du sérotype (Ogawa, Inaba, Hikojima) à l’intérieur du sérogroupe O1 n’est pas utile au diagnostic du choléra ; ces marqueurs déterminés au LNR sont intéressants pour suivre la progression d’une épidémie.
1 Eau Peptonée Salée Alcaline. Un 2ème enrichissement est souhaitable. On ensemence une autre EPSA en prélevant quelques gouttes sous la surface de la 1ère EPSA sans agiter le tube.
2 le sérotypage est effectué au LNR (Laboratoire National de Référence) des Vibrio.
3 les souches appartenant au genre Vibrio sont classiquement sensibles au composé vibriostatique O129, mais des résistances acquises sont apparues rendant ce test moins fiable.
Recherche de Vibrio non cholerae, Aeromonas et Proteus shigelloides
On recherche ces microorganismes chez les malades présentant une diarrhée aiguë au retour d’un pays tropical ou d’une région côtière au climat tempéré et dans le cas où la coproculture standard s’est avérée négative.
Vibrio non cholerae
Les Vibrio non cholerae sont responsables d’infections intestinales appartiennent aux espèces V. parahaemolyticus, V. fluvialis, V. mimicus, V. holisae. Le protocole de leur recherche est semblable à celui de Vibrio cholerae, sauf que l’analyse est poursuivie sur toutes colonies de plus de 2 mm de diamètre obtenue sur TCBS (Saccharose + ou Saccharose -). Pour les raisons indiquées au 4.3.2, la galerie API 20E est préférée à l’API 20 NE.
Aeromonas
Les Aeromonas responsables de diarrhées appartiennent aux espèces A. hydrophila et A. veronii. Ils se développent bien sur le milieu Hektoen, mais donnent des colonies semblables aux E. coli commensaux. Pour faciliter leur repérage, on peut ensemencer une gélose au sang de mouton + ampicilline à 20 µg/mL. Les colonies d’Aeromonas apparaissent, en 24 h, entourées d’une large zone d’hémolyse bêta et tendent à virer au vert brunâtre en 48 h.
L’oxydase est positive et ils résistent au composé vibriostatique O129. Les galeries API 20 NE ou API 20E conviennent à leur identification.
Proteus shigelloides
Proteus shigelloides (anciennement nommé Plesiomonas shigelloides) cultive aussi sur Hektoen (colonies vertes plus larges que celles de Shigella). Le test oxydase est positif (exceptionnel pour une entérobactérie). L’identification peut se faire sur galerie API 20E.
Recherche des microorganismes responsables des diarrhées post-antibiotiques
Clostridium difficile est de loin l’agent infectieux le plus fréquemment en cause dans les diarrhées post-antibiotiques.
Klebsiella oxytoca, Clostridium perfringens, Staphylococcus aureus ou Candida spp sont parfois mis en cause mais leur fréquence reste encore à préciser.
Recherche de Clostridium difficile
On recherche C. difficile chez les malades présentant une diarrhée aigüe qui survient au cours d’une antibiothérapie ou dans les 2 mois suivants l’arrêt de celle-ci. Il est inutile de rechercher C. difficile chez les patients asymptomatiques, car ces patients ne sont pas considérés comme contagieux. La prescription devra préciser « recherche de toxines de Clostridium difficile ».
L’analyse des selles doit être rapide (moins de 2 heures après leur émission) sinon on peut les conserver à + 4°C pendant 3 jours au maximum, afin de ne pas altérer l’activité de la toxine B.
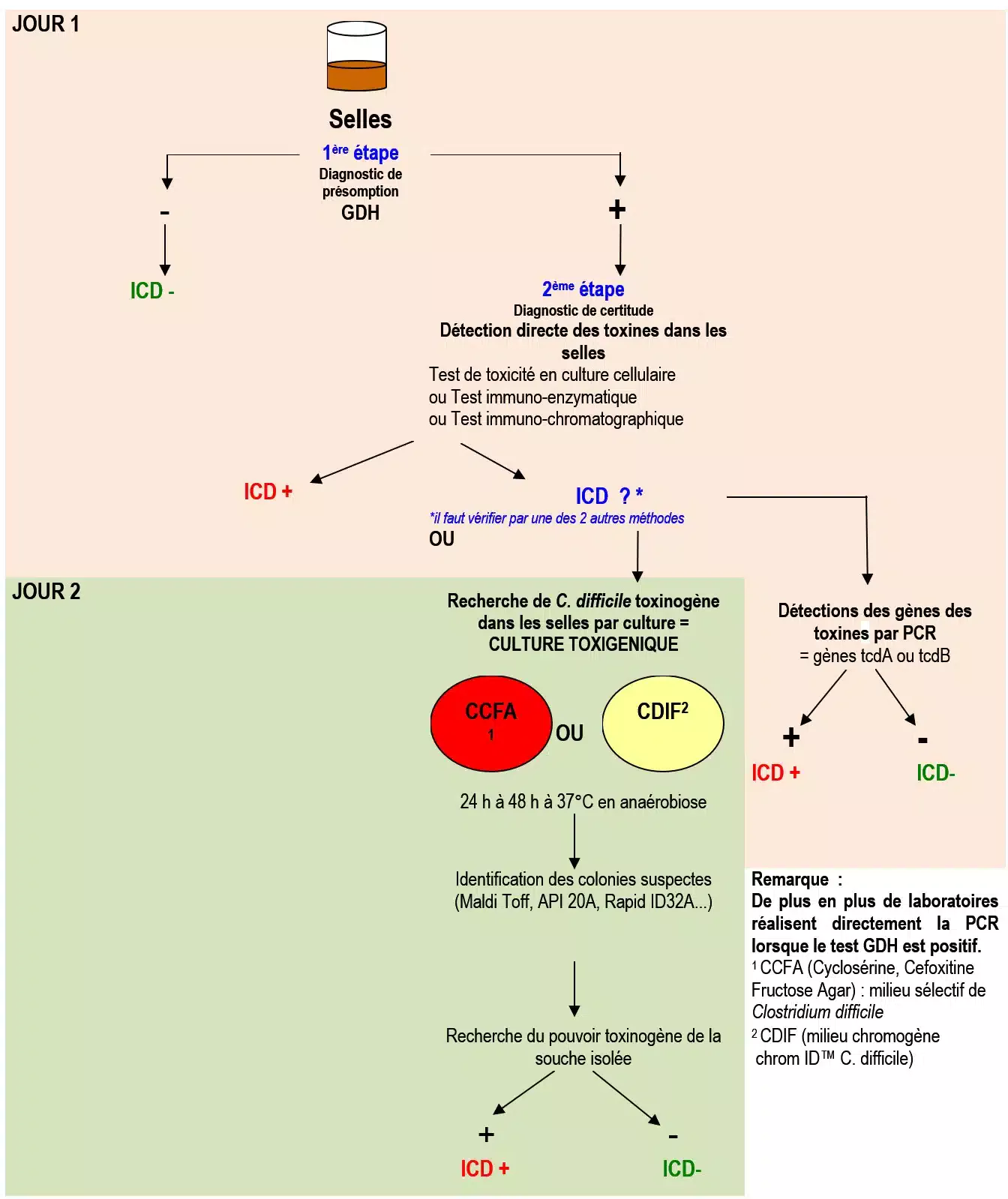
LE DIAGNOSTIC DE PRÉSOMPTION
Le diagnostic de présomption d’infection à Clostridium difficile (ICD) repose sur la détection dans les selles d’une enzyme spécifique de Clostridium difficile : la GDH. Cette enzyme retrouvée spécifiquement chez toutes les souches de Clostridium difficile permet d’obtenir une excellente valeur prédictive négative d’une ICD (c’est-à-dire qu’une ICD est très peu probable si ce test est négatif).
L’examen direct de la selle ne se substitue pas à la recherche de la GDH mais peut cependant être évocateur. En effet, dans 50% des cas, on observe des leucocytes et une flore déséquilibrée dominée par des bacilles à gram positif sporulés avec une spore subterminale peu déformante (Fig. 32)

LE DIAGNOSTIC DE CERTITUDE
Le diagnostic de certitude d’infection à Clostridium difficile (ICD) repose sur la mise en évidence des toxines.
En effet seules les souches toxinogènes sont pathogènes, en conséquence le diagnostic est positif :
- si on détecte directement les toxines (A et/ou B) dans les selles d’un patient ;
- ou si on isole une souche toxinogène de C. difficile de ces mêmes selles.
Il existe différentes méthodes pour mettre en évidence ces toxines :
Mise en évidence d’un effet cytopathogène (ECP)
L’ECP correspond à une ballonisation des cellules (arrondissement du noyau et effondrement du cytoplasme avec apparition d’une forte réfringence). L’ECP est neutralisé par un sérum anti C. difficile pour vérifier la spécificité. On l’utilise pour mettre en évidence la toxine B avec des des cultures cellulaires (MRC5, Vero…). Elle nécessite 48 heures et seuls les centres spécialisés l’effectuent.
Méthodes immunoenymatiques et immunochromatographiques
Elles permettent :
- La détection de la toxine A seule (certains tests recherchent simultanément la glutamate déshydrogénase).
- La détection des deux toxines A et B. On doit privilégier ces tests car on observe de plus en plus de souches toxines A- et B+ (cf. annexe 2).
Ces méthodes sont simples, rapides, spécifiques mais manquent de sensibilité. Elles ne représentent donc pas la meilleure alternative pour faire le diagnostic d’une ICD.
Des tests utilisant la PCR en temps réel
Ils permettent de détecter les gènes de la toxine B (tcdB) ou la toxine A (tcdA) ou une combinaison de plusieurs gènes (tcdB et toxine binaire) directement dans les selles. Ils ont une meilleure sensibilité que les techniques immuno-enzymatiques mais leur coût très élevé ne permet pas, pour l’instant, leur utilisation en routine.
La culture toxigénique
C’est la méthode la plus sensible, elle consiste à rechercher les toxines à partir de colonies de Clostridium difficile. Pour récupérer plus facilement ces colonies, on dispose de différents milieux sélectifs :
- Le milieu CCFA contient deux antibiotiques (Cyclosérine et Céfoxitine) ainsi qu’un glucide (le fructose) et de l’agar. On additionne à ce milieu du jaune d’œuf ou du sang de cheval. Les colonies suspectes après 48h d’incubation en anaérobiose sont plates, de 3 à 5 mm, à bords irréguliers, blanches à grises et non hémolytiques, la culture dégage une odeur caractéristique de « crottin de cheval ».
- BioMérieux commercialise depuis peu un milieu chromogène, appelé chromID™ C. difficile, qui permet de repérer rapidement les colonies de Clostridium difficile. (cf. figure 34).
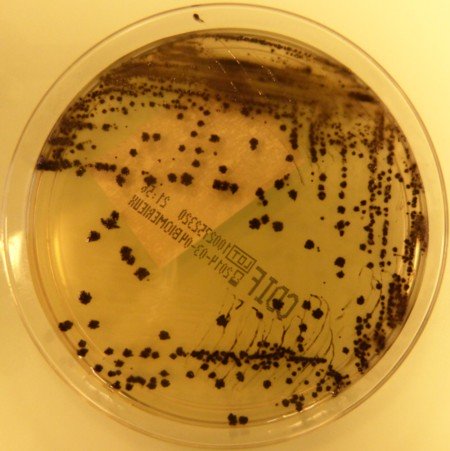
© Pascal Fraperie
À partir de colonies isolées de C. difficile, on prépare une suspension dense en prenant soin de prélever plusieurs colonies ; en effet il n’est pas rare de retrouver dans une même selle des souches toxinogènes et non toxinogènes. Les techniques de détection sont les mêmes que celles déjà présentées (Tests immunoenzymatiques et immunochromatographiques, Test de cytotoxicité, PCR).
Recherche des autres agents responsables de diarrhées post-antibiotiques
Recherche de Klebsiella oxytoca
K. oxytoca a été mise en cause dans des diarrhées sanglantes survenant brusquement pendant une antibiothérapie à base de pénicillines ou plus rarement de céphalosporines.
- Le Gram montre une dominance de bacilles gram négatif
- Sur milieux lactosés comme la gélose BCP ou la gélose Drigalski, les colonies de K. oxytoca sont Lactose + et largement majoritaires
- Poursuivre avec l’ensemencement d’une galerie Api 20 E
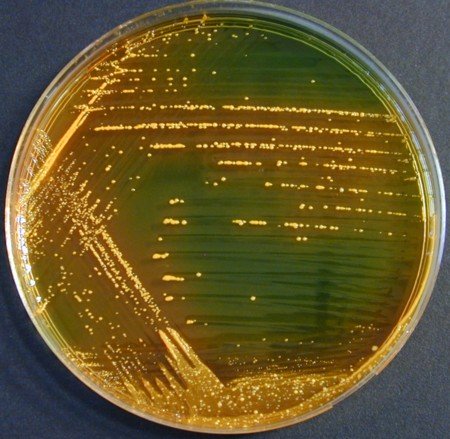
© Pascal Fraperie
Recherche de Clostridium perfringens
C. perfringens est à l’origine de toxi-infections alimentaires. Il semblerait que les souches productrices d’entérotoxines soient aussi à l’origine de diarrhées post-antibiotiques. L’isolement de C. perfringens à partir des selles peut se réaliser sur gélose au sang de mouton ou sur milieu sélectif comme le milieu TSC (tryptose-sulfite-cyclosérine), tous les deux incubés 24 à 48 heures en anaérobiose.
Le diagnostic de présomption de Clostridium perfringens repose sur :
- l’aspect des colonies : plates, irrégulières, et ß-hémolytiques sur gélose au sang (Fig.36)
- la morphologie au Gram : bacilles à Gram positif aux extrémités carrées, sporulés,
- leur immobilité
- leur caractère anaérobie strict
- l’identification de l’espèce (API20A, Rapid ID32A…)
L’entérotoxine peut être détectée, à partir d’une culture sporulée de C. perfringens, par son effet cytopathogène sur culture cellulaire, ou par des tests immunologiques. Le gène correspondant est détectable par PCR.
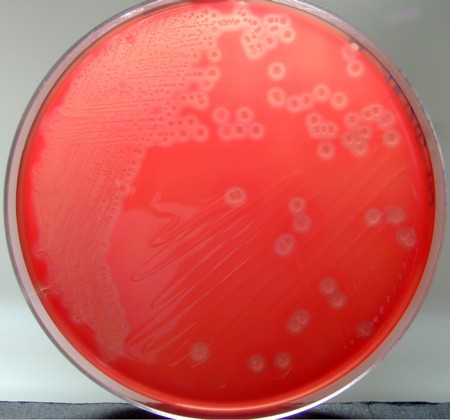
© Pascal Fraperie
Recherche de Staphylococcus aureus
Une étude a montré que la plupart des souches de S. aureus isolées de diarrhées post-antibiotiques étaient des SARM (S. aureus résistants à la méticilline) et produisaient des toxines (entérotoxines A, C et D et la toxine du syndrome du choc toxique TSST-1)
- Le Gram permettra de suspecter leur présence (flore majoritaire de coques gram +, ronds, souvent en amas)
- On ensemence une gélose Chapman à partir des selles non diluées.
- On recherche l’apparition de colonies jaune (mannitol +) sur le milieu Chapman.
- Vérifier la catalase (+)
Il est possible d’identifier Staphylococcus aureus avec un test de coagglutination. Ce test met en évidence la protéine A, le récepteur au fibrinogène et les antigènes capsulaires de Staphylococcus aureus.
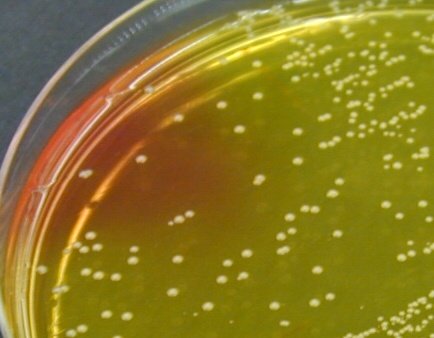
© Pascal Fraperie
Recherche des levures
Le rôle des Candida dans la survenue de diarrhées post-antibiotiques reste incertain et controversé. On recherche les Candida lorsque l’examen direct montre la présence de filaments mycéliens ou de levures. Il faut alors ensemencer les selles pures sur un des milieux sélectifs suivants :
- gélose Sabouraud + chloramphénicol + gentamicine.
- milieu chromogène facilitant le repérage des colonies de Candida albicans (exemples : Gélose chromID™)
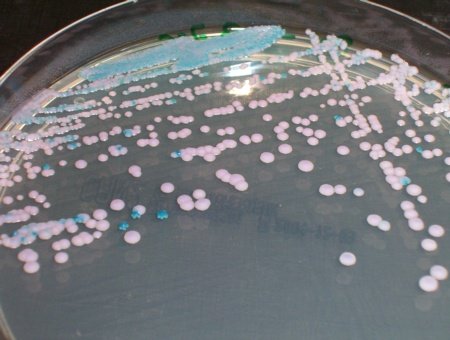
© Pascal Fraperie
RECHERCHE DES VIRUS
On réserve cette recherche aux cas de diarrhées sévères ayant justifié une hospitalisation notamment chez le nourrisson. La microscopie électronique est la technique de référence. Mais l’équipement nécessaire et son manque de sensibilité font que ce n’est pas une technique applicable en routine. La recherche se limite le plus souvent aux rotavirus, norovirus et adénovirus et utilise des tests de détection rapide d’antigènes dans les selles.
Les rotavirus
Les tests antigéniques commercialisés utilisent des anticorps dirigés contre la protéine du groupe VP6 : ils permettent d’identifier les rotavirus du groupe A.
- ELISA en plaque : automatisables ils permettent en moins de 2 heures de tester un grand nombre de selles (excellente sensibilité et spécificité)
- Immunochromatographie sur membrane (rapides, environ 15 minutes mais un peu moins sensibles).
- Agglutination de particules de latex : ces tests sont très rapides (quelques minutes) mais de sensibilité et de spécificité nettement moins bonnes que les tests précédents.
Les norovirus
Des réactifs commerciaux sont disponibles pour détecter les antigènes viraux par une méthode ELISA. Ces techniques présentent une bonne spécificité mais sont cependant moins sensibles que la détection génomique par RT-PCR (reverse transcription-polymerase chain reaction). La cible amplifiée la plus fréquente est la région codant pour l’ARN polymérase. Néanmoins il est utile d’utiliser plusieurs couples d’amorces pour détecter l’ensemble des souches vu la grande diversité génétique de ces virus.
Les adénovirus
Dans les selles, on recherche en routine les sérotypes 40 et 41, (détection d’un antigène de genre) par les mêmes techniques que celles utilisées pour les rotavirus.
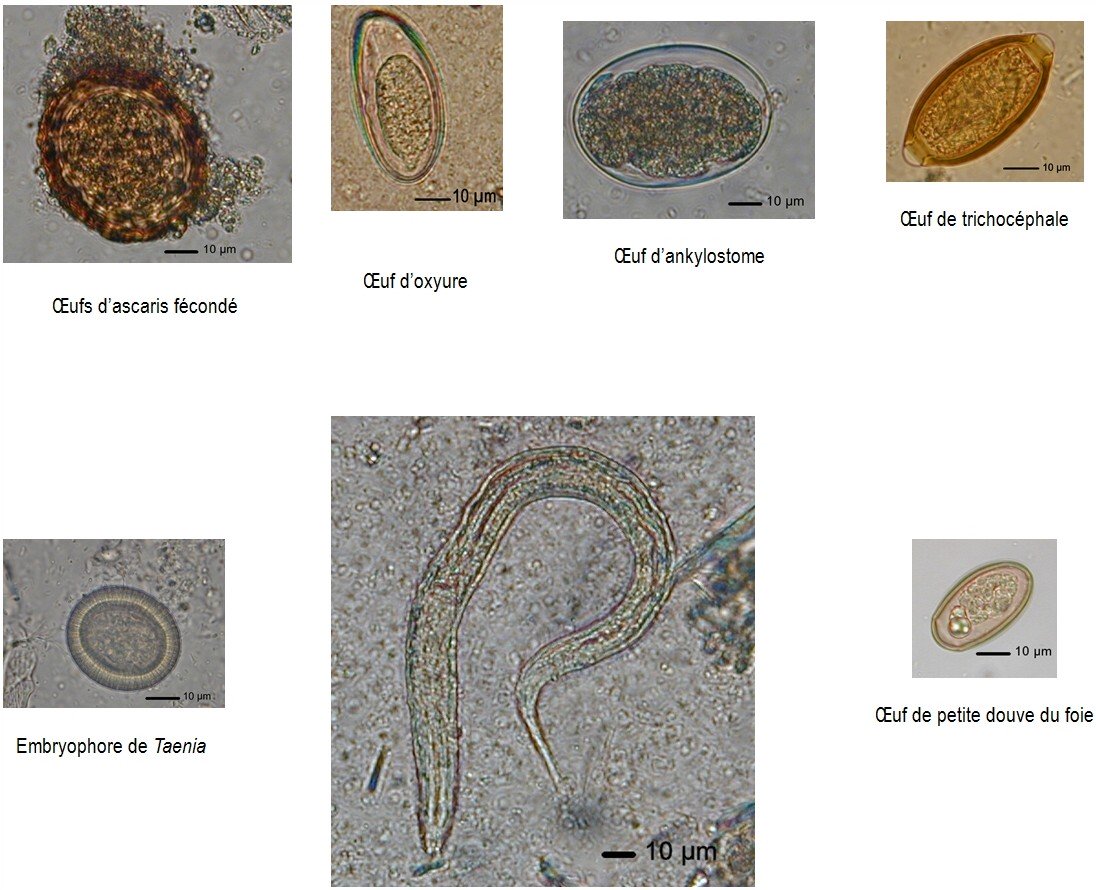
RECHERCHE DES PARASITES
La recherche des parasites se justifie en fonction du contexte clinique et surtout épidémiologique. (Voir la partie « contexte« ).
Pour observer des trophozoïtes mobiles, il est indispensable d’examiner les selles immédiatement. Quand ce n’est pas possible, on conserve les selles dans du formol à 10% ou du Merthiolate-Iode-Formol (MIF).
L’examen parasitologique des selles (EPS) comprend :
- un examen macroscopique. On note la consistance de la selle, la présence de mucus, de sang. On recherche la présence de parasites adultes, visibles à l’œil nu comme les oxyures, les ascaris et les anneaux de ténia.
- un examen microscopique direct des selles fraîches et un examen après enrichissement. Il n’y a pas de technique idéale qui permettrait de concentrer tous les éléments parasitaires ; il faut utiliser obligatoirement deux techniques différentes de concentration, au choix du biologiste. L’élimination des différentes formes de parasites étant discontinue, le résultat isolé d’un EPS négatif n’a pas de valeur. Il ne permet pas de conclure à l’absence de parasites. Il est indispensable de réaliser un deuxième voire un troisième EPS en prévoyant un intervalle de 2-3 jours entre chaque examen.
Giardia duodenalis
- Sur selles molles, pâteuses on cherche la présence de kystes abondants et facile à reconnaître : ovoïdes, de 12 x 8µm, avec des flagelles disposés en S. Plus rarement on trouvera des formes végétatives très mobiles si la selle a pu être examinée rapidement.
- L’avenir est aux tests immunologiques rapides détectant des antigènes parasitaires dans les selles.
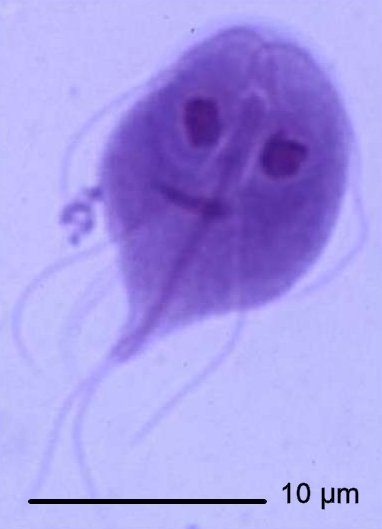
Fig.39 : Forme végétative de Giardia duodenalis http://medchrome.com |
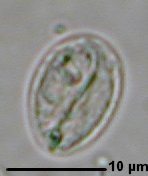
Fig.40 : Kyste de Giardia duodenalis |
Entamoeba histolytica
- Sur selles muco-sanglantes fraîchement émises
- Il est nécessaire de répéter l’examen 2 à 3 fois en cas de négativité
- L’observation à l’état frais ou sur frottis après coloration au trichrome permet, en observant les formes végétatives ou de kystes, de différencier Entamoeba histolytica des classiques Endolimax nanus ou Entamoeba coli. La distinction entre les espèces Entamoeba histolytica et Entamoeba dispar est beaucoup plus difficile et seule la mise en évidence de formes végétatives contenant des hématies permet d’identifier Entamoeba histolytica (fig 42). En effet, les kystes de ces deux espèces présentent la même morphologie (fig 43). En absence de formes végétatives hématophages, il faut utiliser des techniques antigéniques (ELISA) ou génomiques (PCR) pour les distinguer.
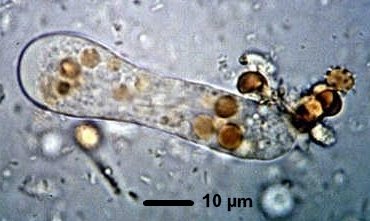 Fig. 41 : Forme végétative d’Entamoeba histolytica Fig. 41 : Forme végétative d’Entamoeba histolytica |
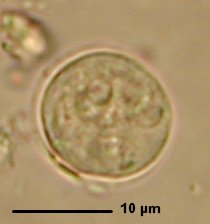 Fig. 42 : Kyste d’Entamoeba histolytica/dispar Fig. 42 : Kyste d’Entamoeba histolytica/dispar© Pascal Fraperie |
Les éléments parasitaires suivant sont tous à la même échelle (© Pascal Fraperie)
COPROCULTURES HORS CONTEXTE D’INFECTION INTESTINALE
Les coprocultures « règlementaires »
Recherche d’un portage de bactérie pathogène chez le personnel de restauration
L’arrêté ministériel du 10/03/1977 et la circulaire du 21/02/1989 imposaient une coproculture à l’embauche (recherche de Salmonella, Shigella ; amibes) et en cas d’infections diarrhéiques. Le dépistage systématique en dehors des épisodes diarrhéiques semble être une mesure coûteuse et inutile (OMS 1989) pour les raisons suivantes :
- l’analyse des quelques cas considérés comme responsables de TIAC montre que la majorité étaient des cuisiniers qui avaient été malades peu de temps avant et continuaient à travailler. C’étaient donc des porteurs convalescents et non porteurs sains.
- le risque de transmission lors de portage asymptomatique est faible si les conditions et les règles universelles d’hygiène sont bien respectées.
- l’excrétion des salmonelles est intermittente, un résultat négatif n’exclut donc pas un portage.
Des textes plus récents (circulaire ministérielle de 1995 et règlement CE 2004) ne prévoient plus d’examens systématiques.
La circulaire laisse au médecin responsable le soin de décider la réalisation de coprocultures en fonction du contexte (diarrhées récentes, retour de voyage). L’exemple suivant relaté dans le BEH du 25 janvier 2011 montre l’intérêt d’une coproculture chez les cuisiniers de retour de voyage.
« En juin-juillet 2006, 11 cas de fièvre typhoïde ont été signalés dans quatre départements d’Île de France. Tous y résidaient ou y avaient séjourné et tous avaient consommé des préparations crues dans un même restaurant parisien. Aucun des employés du restaurant n’avait rapporté de symptômes ou d’antécédents de fièvre typhoïde. S. Typhi a été isolée dans des coprocultures réalisées chez un employé de ce restaurant originaire d’Asie. Les ribotypes et pulsotypes des souches de S. Typhi isolées chez les cas et chez l’employé étaient similaires »
Infections intestinales et éviction scolaire
Les diarrhées à EHEC, à Shigella ainsi qu’une fièvre typhoïde ou paratyphoïde entrainent l’éviction scolaire des enfants atteints. Le Haut conseil de Santé Publique recommande que le retour de l’enfant malade en collectivité se fasse sur présentation d’un certificat médical attestant de 2 coprocultures négatives à au moins 24 heures d’intervalle et au moins 48 h après l’arrêt du traitement.
Recherche d’un portage de bactérie pathogène dans l’entourage d’un patient ou parmi le personnel soignant lors d’une épidémie documentée
Cette coproculture se pratique sur des selles mêmes solides.
Détection du portage de bactéries multirésistantes (BMR)
A des fins épidémiologiques, chez les malades hospitalisés dans des services à risques (réanimation ou oncohématologie) et le personnel soignant, on vérifie l’absence de portage de Bactéries Multi-Résistantes (BMR).
La recherche de certaines BMR s’effectue dans les selles ou un écouvillonage rectal telles que :
- Enterococcus résistant à la vancomycine ;
- Entérobactéries productrices de BLSE.
La coproculture quantitative de la flore aérobie fécale
Certains patients immunodéprimés comme les patients aplasiques des services d’onco-hématologie, subissent une décontamination digestive afin de réduire quantitativement une partie de leur flore aérobie intestinale.
Une fois par semaine, on effectue une coproculture quantitative pour évaluer l’efficacité de la décontamination.
Pour effectuer ce dénombrement, il faut ensemencer différents milieux de culture par étalement de 100 µL des dilutions 10-2 et 10-5 des selles.
Exemple de protocole :
Ensuite il s’agit de dénombrer et étudier la sensibilité aux antibiotiques de tous les microorganismes isolés.