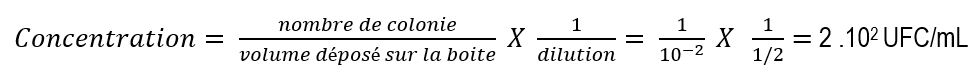Le pronostic de la mucoviscidose dépend de l’ampleur des lésions bronchiques et parenchymateuses liées aux infections bactériennes. C’est pourquoi une surveillance bactériologique des colonisations bactériennes est essentielle. Elle exige de respecter des recommandations concernant la qualification des prélèvements, le seuil de dénombrement des différentes espèces, les milieux de culture et l’antibiogramme. (recommandations pour la prise en charge des patients atteints de mucoviscidose – conférence de consensus des 18 et 19 novembre 2002).
Modalités de prélèvement
Différents prélèvements bactériologiques sont disponibles :
- On recommande le recueil d’expectoration spontanée ou provoquée.
- En l’absence d’expectoration, on peut éventuellement réaliser :
- un écouvillonnage pharyngé, seul examen validé par comparaison au LBA ;
- l’aspiration nasopharyngée, fréquemment utilisée et bien tolérée chez le nourrisson mais pas encore évaluée.
En revanche, le lavage bronchoalvéolaire (LBA) est trop invasif pour être utilisé. Il est cependant l’examen de référence auquel on compare les autres techniques
Examens microscopiques
L’observation d’un frottis de l’expectoration ou de l’aspiration nasopharyngée permet de s’assurer de la qualité du prélèvement en calculant le score de Murray et Washington (comparaison du nombre de granulocytes neutrophiles et du nombre de cellules épithéliales pharyngées).
Dans le cas de patient mucoviscidosique, on ensemence les milieux quel que soit le score obtenu.
Fluidification
Les expectorations et aspirations nasopharyngées sont fluidifiées en les mélangeant volume à volume avec un agent mucolytique.
Dénombrement des germes
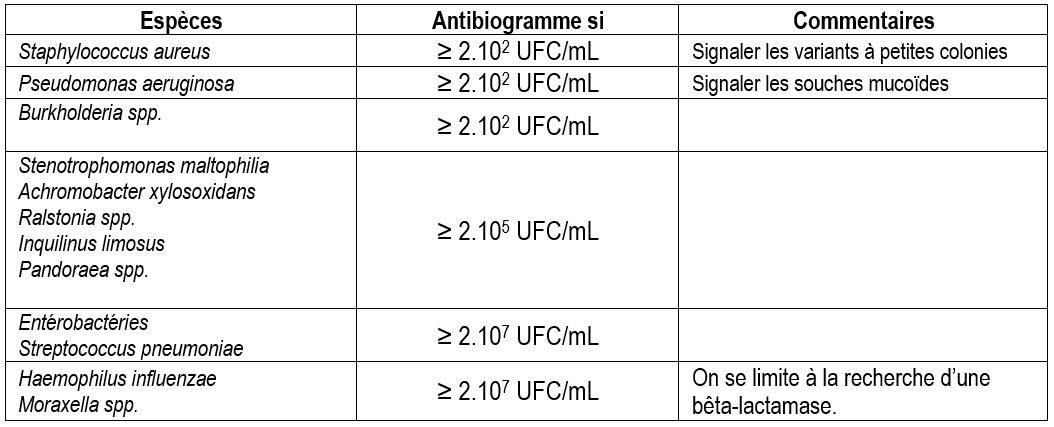
Les seuils au-delà desquels un antibiogramme doit être effectué sont bien plus bas que chez les sujets non mucoviscidosiques. Ils dépendent en partie des espèces isolées (Tableau 10).
Dans le REMIC 2015, il est préconisé d’ensemencer certains milieux d’isolement avec 10 µL de fluidifiat et d’autres avec une dilution au 1/1000 du fluidifiat. Le choix des milieux dépend bien sur des germes recherchés.
Le schéma présente les différentes étapes de l’analyse ainsi que les milieux choisis et la justification de leur choix.
On peut aussi choisir d’ensemencer les milieux avec 100 µL d’inoculum en utilisant les dilutions 10-1 et 10-4 du fluidifiat.
Calcul du seuil de détection
Si on prend le cas d’un germe qui forme une colonie après que le milieu ait été ensemencé avec 10 µL de fluidifiat alors sa concentration dans le crachat est la suivante :
avec : volume déposé sur la boite = 10 µL soit 10-2 mL
dilution = 1/2 car le crachat est dilué au ½ lors de la fluidification.
Le seuil de détection est identique si on a choisi de déposer 100 µL de la dilution 10-1 du crachat.
Dans la littérature, il est écrit que pour certains germes, il est nécessaire de faire un antibiogramme lorsque leur concentration dépasse 2 .102 UFC/mL. En fait ce seuil est franchi dès qu’il apparait une colonie de ce germe sur une gélose ensemencée avec 10 µL de fluidifiat.
De la même façon la concentration de 2.105 UFC/mL est dépassée chaque fois qu’une colonie est obtenue sur une gélose ensemencée avec 10 µL de la dilution 10-3 du fluidifiat.
Interprétation des cultures selon les espèces pathogènes détectées
Staphylococcus aureus
S’il apparait pour la première fois, on réalise un antibiogramme et ce quelle que soit sa concentration.
Ensuite on refera un antibiogramme si lors des exacerbations sa concentration est supérieure ou égale à 2.105 UFC/mL.
Il existe des S. aureus « variants à petites colonies » apparaissant généralement après 48 à 72 heures d’incubation. Ces variants sont à localisation intracellulaire et responsables en partie du caractère pérenne de S. aureus au sein des voies aériennes bronchiques. Ces souches doivent être signalées au clinicien car la présence de variants à petites colonies nécessite un traitement particulier à base de rifampicine (antibiotique présentant une bonne pénétration cellulaire) associée à de l’acide fusidique.
Pseudomonas aeruginosa
L’aspect macroscopique des colonies est souvent atypique.
Systématiquement et ce quelle que soit sa concentration, il est nécessaire de réaliser un antibiogramme.
Plusieurs morphotypes peuvent être présents simultanément et lors de la primocolonisation, il faut faire un antibiogramme pour chacun d’eux.
Lors des exacerbations suivantes, il est permis de faire un antibiogramme en préparant un inoculum mélangeant les différents morphotypes.
La fonction respiratoire se dégrade rapidement en présence de souches mucoïdes de Pseudomonas aeruginosa, c’est pourquoi il est nécessaire de préciser au clinicien, le caractère muqueux ou non des souches.
Burkholderia cepacia
Par prudence, il faut s’assurer que les colonies apparues sur la gélose sélective de B. cepacia appartiennent bien à cette espèce.
Systématiquement et ce quelle que soit sa concentration, il est nécessaire de réaliser un antibiogramme.
Autres bacilles à Gram négatif non fermentants
Ce sont les Stenotrophomonas maltophilia, Achromobacter, Ralstonia, Inquilinus et Pandoraea.
Leur présence doit toujours être signalée et un antibiogramme systématiquement réalisé.
On les considère toutefois susceptibles d’être pathogènes seulement si leur concentration dépasse 2.105 UFC/mL.
Streptococcus pneumoniae et les entérobactéries
On réalise un antibiogramme seulement si leur concentration est supérieure ou égale à 2.107 UFC/mL, à savoir au moins 100 colonies sur les milieux ensemencés avec la dilution 10-3 du fluidifiat.
Haemophilus influenzae et Moraxella catarrhalis
On se limite à rechercher la production de bêta-lactamase par un test chromogénique si leur concentration est supérieure ou égale à 2.107 UFC/mL.
Levures et champignons filamenteux
Aspergillus fumigatus est l’espèce la plus fréquemment isolée.
Tableau 10 :