PLAN
-
L’analyse du LCR est une urgence
- Prélèvement et transport du LCR
- Étapes de l’examen du LCR
- Examen macroscopique
- Mise en culture
- Examen cytologique
- Paramètres biochimiques utiles au diagnostic
- Orientation cytologique et biochimique du diagnostic
- Etude de la flore microbienne
- Recherche des antigènes solubles
- Amplification génique
- Identification après culture
- Rôle du laboratoire dans le choix de l’antibiothérapie
- Autres examens biologiques
L’analyse du LCR est une urgence
La méningite reste toujours une maladie d’actualité. Le caractère foudroyant de cette maladie fait que le taux de mortalité ne diminue pas. Pourtant la presque totalité des germes responsables de méningites purulentes sont très sensibles aux « nouveaux antibiotiques ».
Pour réduire ce taux de mortalité, il faut accélérer le diagnostic et la prise en charge thérapeutique des méningites.
C’est pourquoi, l’examen d’un LCR au laboratoire est un examen urgent.
Prélèvement et transport du LCR
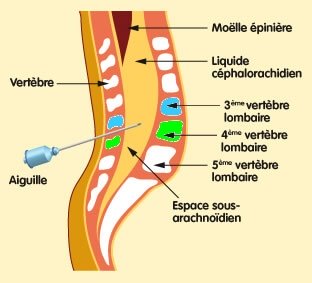
Le LCR est prélevé, idéalement avant toute antibiothérapie, par ponction lombaire, après une asepsie rigoureuse de la peau, entre les vertèbres lombaires L3-L4 ou L4-L5 (Fig.9)
On le recueille dans un minimum de 3 tubes stériles numérotés 1, 2 et 3.
Le volume total doit être compris entre 2 à 5 mL. Prévoir 1 à 2 mL supplémentaire en cas de recherche complémentaire comme celle des mycobactéries.
- le tube 1 pour l’analyse biochimique ;
- le tube 2 pour l’analyse cytologique ;
- enfin le tube 3 pour la mise en culture.
Comme cette analyse est urgente mais aussi parce que certaines bactéries comme le méningocoque sont très fragiles, le transport du LCR au laboratoire doit se faire rapidement (moins de 30 minutes), en évitant tout refroidissement.
Un minimum de renseignements doit être transmis au laboratoire :
- traitement antibiotique en cours ;
- l’âge ;
- le statut immunitaire et le type d’immunodépression ;
- le contexte clinique et épidémiologique : convulsion, purpura, cas dans l’entourage, actes de neurochirurgie ou de chirurgie ORL…
En règle générale, on réalise une hémoculture en parallèle.
Étapes de l’examen du LCR
Examen macroscopique
Étant donné que le diagnostic de la méningite est urgent, cet examen macroscopique est souvent capital. En effet, l’observation d’un LCR trouble suffit pour diagnostiquer une méningite.
Le LCR peut se présenter sous les aspects suivants :
LCR troubles
Un liquide trouble est toujours pathologique et signe, dans la plupart des cas, une méningite d’étiologie bactérienne et d’évolution aiguë. Son observation par le celui qui pratique la ponction est donc très importante car elle implique l’instauration immédiate d’un traitement antibiotique probabiliste sans attendre les résultats de l‘antibiogramme. Dans le cas de méningites communautaires, un traitement anti-inflammatoire avec des corticoïdes l’accompagne afin de réduire les risques de mortalité et la fréquence des séquelles auditives et neuromotrices.
LCR clairs
On les décrit en général comme « eau de roche ».
Lorsque le LCR est clair, il existe 2 possibilités :
- soit il est normal
- soit c’est une méningite à liquide clair ; les agents étiologiques sont très variés :
- Listeria monocytogenes ;
- mycobactéries tuberculeuses (le plus souvent Mycobacterium tuberculosis = bacille de Koch ou BK) ;
- virus ;
- Cryptococcus neoformans ;
- Treponema pallidum (méningite syphilitique) ;
- Leptospira interrogans ;
- la maladie de Lyme : elle survient quelques semaines ou quelques mois après une piqûre infestante de tiques (inoculant Borrelia burgdorferi).
Le LCR lors d’une méningite bactérienne décapitée par un traitement antibiotique peut aussi être clair.
Notons enfin que le LCR est clair lors de méningites non infectieuses comme les méningites néoplasiques et les méningites médicamenteuses.
LCR jaune citrin = xanthochromiques
La coloration jaune du liquide céphalo-rachidien s’explique par la transformation de l’hémoglobine en pigments hématogènes au cours d’une hémorragie méningée.
LCR hémorragiques
Deux causes sont possibles :
- une hémorragie méningée accompagnant ou pas une méningite bactérienne ;
- ou bien une rupture d’un vaisseau au cours du prélèvement.
Pour distinguer ces deux possibilités, on peut :
- prélever le LCR dans 3 tubes différents. Seul le premier tube (voire le second) est sanglant dans le cas de la rupture d’un vaisseau au cours du prélèvement
- ou alors centrifuger le LCR : le surnageant est xanthochromique dans le cas d’une hémorragie méningée.
Enfin la cytologie et l’analyse biochimique du LCR permettent de distinguer une hémorragie méningée compliquant une méningite bactérienne, d’une hémorragie méningée sans méningite.
Mise en culture
Milieux ensemencés systématiquement, quel que soit l’aspect du LCR et sa concentration en leucocytes
On ensemence des milieux permettant la croissance des bactéries exigeantes responsables de méningites purulentes.
- Le milieu polyvalent ensemencé est la gélose chocolat enrichie. On l’incube à 35°C sous une atmosphère de 5 à 10% de CO2.
- Une gélose au sang permettra de repérer plus facilement Streptococcus pneumoniae. On l’incube à 35°C sous une atmosphère de 5 à 10% de CO2.
- Un bouillon type cœur-cervelle permet de cultiver les bactéries en diluant les éventuels antibiotiques présents dans le LCR (l’idéal étant cependant un flacon d’hémoculture avec des produits adsorbants les antibiotiques), incubé à 35°C.
Si le volume de LCR est suffisant, on peut ensemencer une gélose BCP pour faciliter l’orientation de l’identification du germe.
On prendra de soin de préchauffer les milieux à 37°C. En effet certains germes comme le méningocoque sont très sensibles au refroidissement.
La technique d’ensemencement peut tenir compte de la présence ou pas de germes à l’examen microscopique :
- isolement classique après avoir déposé 1 goutte si l’examen microscopique est positif.
- ensemencement par étalement avec un ensemenceur-râteau de 5 à 10 gouttes de liquide non centrifugé en cas d’examen microscopique négatif. L’étalement se fait à la pipette râteau.
Ensuite placer les milieux immédiatement à l’étuve.
On observe les milieux après 18h et 48h d’incubation à 35°C et on les laisse à l’étuve au moins 5 jours si absence de culture (au moins 15 jours si suspicion de Brucella).
Milieux ensemencés selon les circonstances
- la gélose Sabouraud sans actidione incubée pendant 1 mois à 35°C si le sujet est immunodéprimé ;
- des milieux pour mycobactéries si le LCR présente une prédominance de lymphocytes (on ensemence ce milieu avec le culot de centrifugation) ;
- un milieu pour bactéries anaérobies strictes (gélose Schaedler + vit K3 + sang de mouton) incubée à 37°C en anaérobiose dans le cas de méningites nosocomiales ;
- le bouillon EMJH pour la recherche des leptospires, incubé à 30° durant 2 mois.
| Compte-tenu de l’urgence de l’analyse, on peut reprocher à la culture sa lenteur mais elle reste une méthode très sensible et permet de réaliser l’antibiogramme de l’agent pathogène. Elle peut être négative dans le cas de l’administration préalable, souvent justifiée, d’un traitement antibiotique à large spectre. On parle de méningite décapitée. |
Examen cytologique
Numération des leucocytes (sur le LCR non centrifugé)
Elle n’est pas nécessaire pour les liquides troubles car le trouble atteste d’un nombre de leucocytes supérieur à 200 par mm3.
Après agitation douce du LCR, on réalise la numération en cellule de comptage.
Un LCR normal contient moins de 5 leucocytes par mm3 (10 à 30/mm3 chez le nouveau-né).
Lors de méningite à liquide clair, le nombre de leucocytes est supérieur à 100 /mm3.
Formule leucocytaire
On l’établit après cytocentrifugation et coloration au May-Grunwald-Giemsa.
En absence de cytocentrifugeuse, on prépare un frottis à partir d’une goutte du culot de centrifugation que l’on étale comme un frottis sanguin.

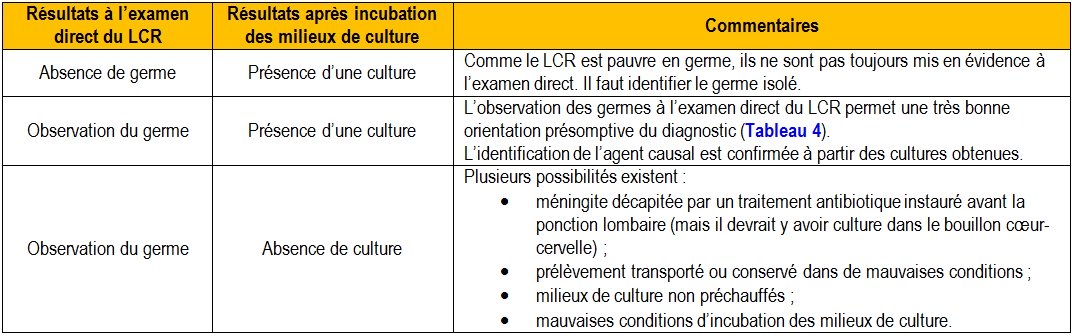
Figure 10 : La cytocentrifugeuse
Dans le cas des liquides troubles, on observe une forte majorité de granulocytes (80 à 100%) sauf dans les méningites à Listeria pour lesquelles les 3 types de cytologies sont observées (prédominance de granulocytes, prédominance de lymphocytes, formule mixte).
Dans le cas des méningites à liquides clair, une prédominance de lymphocytes oriente vers une méningite tuberculeuse et une méningite virale.
Remarque : une formule présentant plus de 10% granulocytes éosinophiles dans le LCR s’observe lors d’helminthiases (Angiostrongylus cantonensis, Gnathostoma spinigerum,..), de leucémies ou à la suite de traitements médicamenteux.
Paramètres biochimiques utiles au diagnostic
Des analyses biochimiques du LCR et du sérum sont utiles pour orienter le diagnostic.
Examen biochimique du LCR
- glycorachie (dosage du glucose) ;
- protéinorachie (dosage des protéines) ;
- dosage du lactate ;
- dosage de l’interféron alpha.
Examen biochimique du sérum
- glycémie
- dosage de la procalcitonine ;
- dosage de la CRP
Rapport glycorachie/glycémie
La glycorachie doit toujours être exprimée en fonction de la glycémie. Une glycorachie normale est égale à 65% de la glycémie.
Une hypoglycorachie oriente vers une méningite bactérienne.
L’hypoglycorachie s’explique par la réduction du transfert du glucose à travers la barrière hémato-méningée, et la consommation de glucose par la réaction inflammatoire.
Ainsi, dans le cas de LCR clair, la glycorachie aide à distinguer les étiologies tuberculeuses et virales (elle est inférieure à 40% de la glycémie pour les méningites tuberculeuses et est supérieure à 50% de la glycémie lors de méningite virale). Ce critère à lui seul ne suffit pas car certaines méningites virales s’accompagnent d’une hypoglycorachie.
Elle permet aussi de suivre l’évolution d’une méningite : la glycorachie est le premier paramètre à se normaliser. Une persistance de l’hypoglycorachie est de mauvais pronostic.
Protéinorachie
Les valeurs normales de la protéinorachie se situent entre 0,10 et 0,45 g/L (la protéinorachie du nouveau-né et du nourrisson de moins de 2 mois est cependant plus élevée).
Une protéinorachie très élevée oriente vers une méningite bactérienne. Elle varie de 1 à 5 g/L lors de méningites purulentes.
La protéinorachie peut aussi être légèrement augmentée lors de méningite virale, sans dépasser 1,5 g/L.
L’hyperprotéinorachie peut persister 2 à 3 semaines après le début du traitement.
Dosage du lactate dans le LCR
Le lactate est le témoin d’un métabolisme anaérobie. Pendant, un temps abandonné, une étude récente lui redonne de l’intérêt.
On constate en effet que lors de méningite bactérienne la concentration en lactate dans le LCR est toujours supérieure à 3,2 mmol/L.
Dosage de l’interféron alpha dans le LCR
L’interféron alpha, cytokine de l’immunité innée produite seulement en présence de virus, est utilisé comme marqueur précoce des méningoencéphalites virales.
Dosage de la procalcitonine et de la CRP dans le sérum
La procalcitonine est une protéine inflammatoire sécrétée par la thyroïde et dont la concentration sérique augmente très rapidement à la suite d’une agression bactérienne. Ce marqueur permet de distinguer rapidement les méningites virales des méningites bactériennes.
Au-delà d’un seuil de 0,5 ng/mL, la méningite est considérée bactérienne avec une sensibilité de 99% et une spécificité de 83%.
La CRP (protéine C réactive) est une protéine de l’inflammation sécrétée par le foie. Elle a été la première utilisée pour différencier les méningites bactériennes des méningites virales mais ce marqueur biologique est, à la fois, moins sensible et moins spécifique que la procalcitonine sérique. Valeur normale < 0,5 mg/L
Orientation cytologique et biochimique du diagnostic
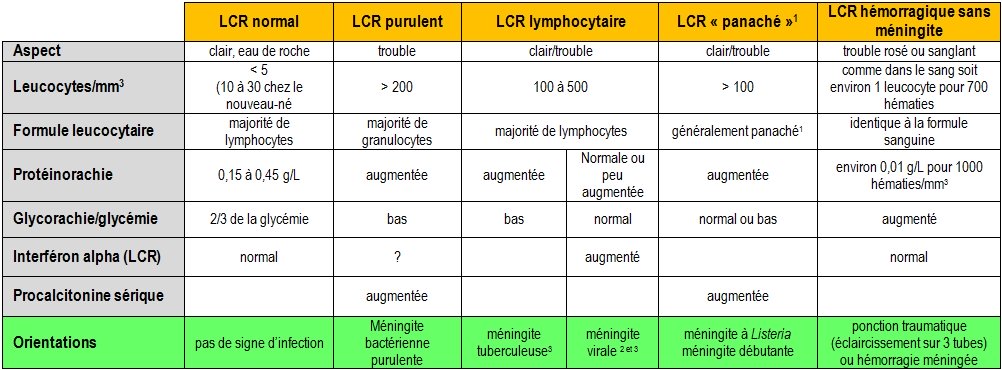
En fonction des résultats des examens macroscopique, cytologique et biochimique du LCR, on distingue classiquement cinq grandes catégories : LCR normal, LCR purulent, LCR lymphocytaire, LCR « panaché » et LCR hémorragique sans méningite.
Tableau 3 : Orientation cytologique et biochimique du diagnostic
1 Panaché = granulocytes et lymphocytes en proportions proches.
2 Les méningites à entérovirus se traduisent par un LCR clair avec une majorité de granulocytes.
3 Autres étiologies de LCR lymphocytaire :
- Cryptococcus neoformans avec glycorachie normale ou abaissée.
- Brucellose, Maladie de Lyme, Leptospirose, Syphilis avec glycorachie normale
Étude de la flore microbienne
Observation après coloration de Gram
On la réalise de préférence après cytocentrifugation ou à partir du culot de centrifugation du LCR.
Les germes étant rares dans un LCR, l’examen microscopique doit être patient et minutieux.
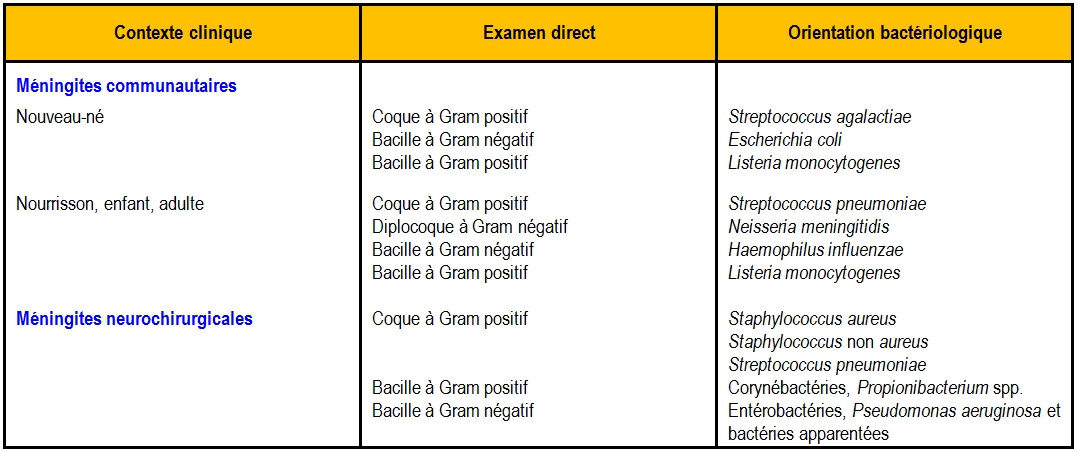
- Chez les sujets qui n’ont pas été traités aux antibiotiques avant le prélèvement, l’examen direct est positif dans environ 80 % des cas (c’est-à-dire que l’agent causal est observé au Gram). Comme les principales espèces bactériennes responsables de méningites se distinguent par leurs caractères microscopiques (Tableau 4), cet examen est très précieux pour orienter le diagnostic et surtout adapter l’antibiothérapie.Par exemple, l’observation de bacilles à Gram positif doit être rapidement signalée car les céphalosporines de troisième génération, habituellement administrées en première intention pour traiter les méningites bactériennes, sont inefficaces sur les Listeria.La densité des germes dans le LCR varie selon les espèces, c’est pourquoi la sensibilité de l’examen microscopique est meilleure pour S. pneumoniae et H. influenzae que pour N. meningitidis, L. monocytogenes ou M. tuberculosis.
- Enfin la sensibilité de l’examen microscopique passe à 60% chez les sujets traités avec un antibiotique avant le prélèvement.
Tableau 4 : orientation bactériologique en fonction de l’examen direct
Recherche des mycobactéries
Dans le cas de LCR clair ou légèrement trouble et en présence d’une prédominance de lymphocytes, il faut rechercher les mycobactéries.
L’examen direct du frottis coloré par la méthode de Ziehl, Kinyoun ou de Degommier (auramine) doit être très attentif car les mycobactéries sont toujours peu nombreuses dans le LCR. L’examen direct est exceptionnellement positif.
La mise en culture est systématique. Des milieux comme le milieu de Loewenstein-Jensen et/ou le milieu MGIT sont ensemencés avec le culot de centrifugation du LCR (décontamination inutile). Pour plus de précision, voir la page sur la recherche des mycobactéries.
Recherche de Cryptococcus neoformans
Elle se justifie chez les patients immunodéprimés. Un examen direct à l’encre de Chine permet de mettre en évidence cette levure capsulée.
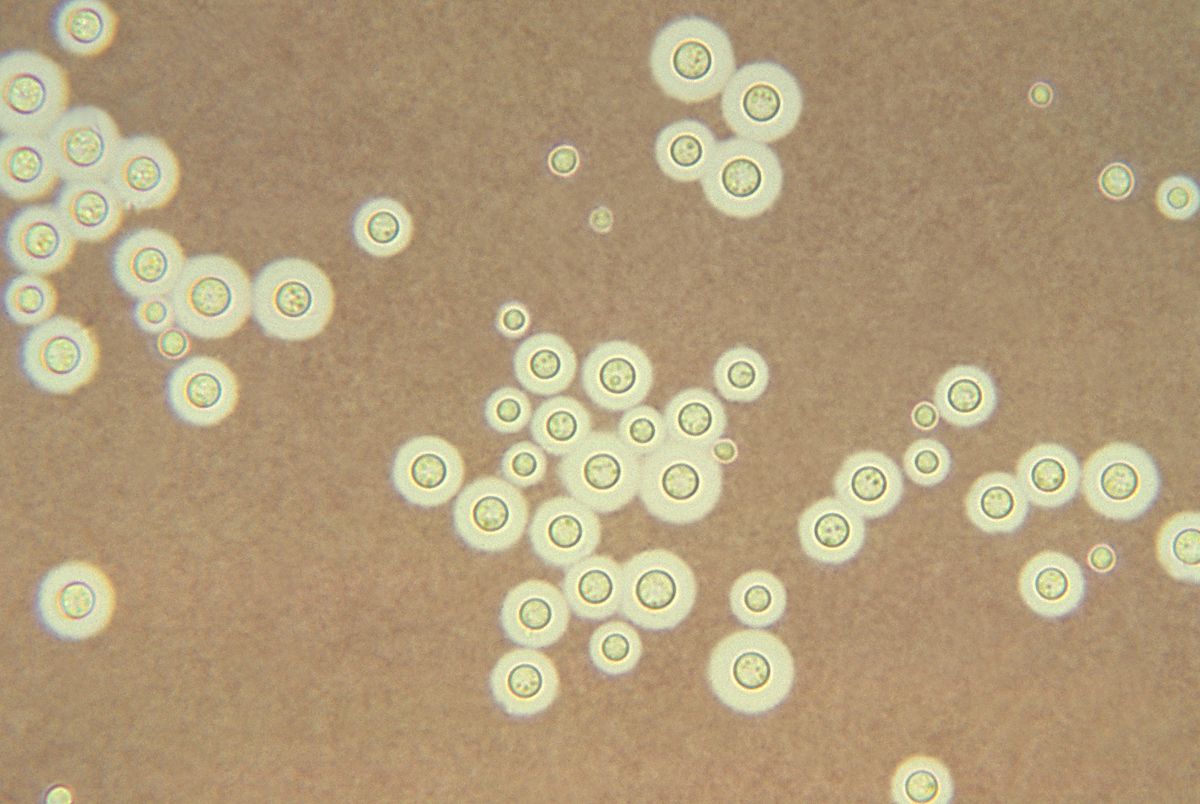
CC by Dr. Leanor Haley via Wikimedia Commons
Recherche des antigènes solubles
Les antigènes solubles ou exo-antigènes sont des antigènes bactériens de surface (capsule, couche externe de la paroi), de nature généralement osidique, qui se détachent de la bactérie et se trouvent libres dans les liquides biologiques. Leur mise en évidence par des méthodes immunologiques permet l’identification présomptive du germe.
Cette méthode présente de nombreux intérêts :
- gain de temps dans l’identification de l’agent causal ;
- identification présomptive de l’agent causal alors que les cultures sont restées négatives (par exemple si le sujet a été traité aux antibiotiques avant le prélèvement ou si les conditions de transport ou de culture n’ont pas été respectées) ;
- elle permet de rectifier une orientation diagnostique face à un examen microscopique montrant des bactéries présentant une morphologie et/ou une coloration déroutantes.
Quels que soient les résultats, la mise en culture dans les milieux précédemment cités est indispensable.
Cette recherche manque cependant de sensibilité, en effet elle est rarement positive en cas d’examen microscopique négatif.
Deux méthodes sont principalement pratiquées :
- l’agglutination de particules de latex sensibilisées ;
- la recherche d’antigènes solubles de Streptococcus pneumoniae par immunochromatographie.
Agglutination de particules de latex sensibilisés
On utilise des particules de latex sensibilisées avec les anticorps spécifiques des antigènes solubles susceptibles d’être rencontrés dans un LCR.
Ainsi il existe des latex permettant de repérer les antigènes solubles de :
- Streptococcus pneumonaie ;
- Haemophilus influenzae b ;
- N. meningitidis avec 4 latex différents : sérotype A, sérotype B / E. coli K1 (communauté antigénique), sérotype C et enfin sérotype Y/W135 ;
- Streptococcus agalactiae (streptocoque B)
On chauffe préalablement le LCR à 80°-100°C pendant 5 min, puis centrifugé 10 min à 2000 t/min (la sensibilité est 5 fois plus grande si l’échantillon est d’abord traité aux ultrasons).
Ensuite on mélange, sur une lame de verre, une goutte de surnageant avec une goutte de chaque suspension de particules de latex. L’apparition, en moins de deux minutes, d’une agglutination dans l’un des réactifs permet de donner le résultat.
Un témoin positif permet de vérifier périodiquement l’activité des latex sensibilisés.
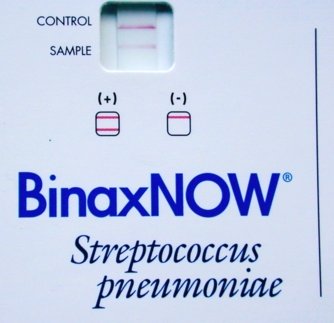
Recherche d’antigènes solubles de Streptococcus pneumoniae par immunochromatographie
Le test BinaxNOW® S.pneumoniae permettant de rechercher le polyoside C de la paroi du pneumocoque présente beaucoup d’intérêt pour le diagnostic rapide des méningites à Streptococcus pneumoniae.
Sa sensibilité est de 95% et sa spécificité de 100%.
Cette méthode est plus sensible que l’agglutination de particules de latex sensibilisées.
© Pascal Fraperie
Amplification génique
Il existe des tests ciblés sur un agent bactérien ou viral précis et d’autres qui détectent la présence de divers micro-organismes (PCR universelle).
Les techniques d’amplification génique se justifient chez des patients présentant manifestement une méningite purulente et pour lesquels :
- les examens microscopiques sont négatifs ;
- les examens microscopiques sont positifs et les cultures négatives.
Des kits existent pour la recherche spécifique de certains germes comme le méningocoque et le pneumocoque.
Si les premiers résultats orientent vers une méningite virale, des techniques d’amplification génique sont utilisées d’emblée pour identifier le virus en cause. En première intention sont pratiquées :
- une RT-PCR Enterovirus (test GeneXpert®) car ce sont les virus les plus fréquents
- une PCR HSV1 et 2 car le diagnostic de ces méningites est urgent.
Si ces premiers tests sont négatifs, des PCR multiplex permettent d’identifier plusieurs autres virus : VZV, CMV, EBV, HHV6, adénovirus.
A l’inverse de la RT PCR Enterovirus et de la PCR HV1 et 2, ces tests mettent en œuvre simultanément des sondes très variées et spécifiques des différents microorganismes recherchés.
Pour les germes à croissance lente comme les leptospires les techniques d’amplification géniques sont recommandées.
Identification après culture
Le tableau 5 présente trois combinaisons possibles de résultats.
Tableau 5 :
La démarche d’identification dépend des germes, par exemple :
Streptococcus pneumoniae :
- Diplocoque à Gram positif, catalase négatif
- Sensible à l’optochine
Haemophilus influenzae :
- Petit bacille à Gram négatif, polymorphe, oxydase + (faible)
- exigeant pour sa croissance les facteurs X et V
- profil biochimique par exemple sur API NH® (bioMérieux) : les caractères ODC, uréase et idole servent à s’assurer que la souche est bien un Haemophilus influenzae et à déterminer son biotype
- sérogroupage.
Neisseria meningitidis :
- Diplocoques à Gram négatif, oxydase +, catalase +
- profil biochimique : API NH® (bioMérieux) ou Neisseria 4H® (Biorad) : glucose +, maltose +, fructose -, saccharose -, gamma GT +
- envoi de la souche au CNR des méningocoques pour le sérogroupage. Le sérogroupage permet de déterminer quel vaccin utilisé pour les sujets contacts.
Rôle du laboratoire dans le choix de l’antibiothérapie
Les sujets souffrant de méningite doivent être traités d’extrême urgence avec des antibiotiques, leur pronostic vital est en jeu.
L’antibiotique choisi doit à la fois être capable de diffuser dans le LCR et présenter une activité bactéricide sur le germe en cause.
Compte tenu de l’urgence le traitement antibiotique est instauré avant que les résultats de l’antibiogramme soient rendus.
L’émergence de souches résistantes justifie l’emploi en première intention d’antibiotiques à large spectre, par exemple les céphalosporines de troisième génération (le céfotaxime ou la ceftriaxone).
Comme certaines souches de pneumocoque présentent une sensibilité diminuée aux céphalosporines de 3e génération (C3G), les experts recommandent d’administrer une association C3G-vancomycine en première intention devant toute méningite supposée à pneumocoque
Le rôle du laboratoire est d’orienter le plus vite possible l’identification de l’agent causal afin de s’assurer de l’efficacité présomptive du ou des antibiotiques administré en première intention (les Listeria, nous l’avons vu précédemment, sont naturellement résistantes aux C3G).
L’antibiogramme peut être réalisé directement avec le LCR lorsque l’examen direct est positif mais les CMI doivent être contrôlées par la suite avec un inoculum standardisé.
L’antibiogramme permet de s’assurer de l’efficacité de l’antibiotique administré en première intention et éventuellement de choisir un antibiotique présentant un spectre plus étroit (par exemple C3G remplacé par amoxicilline).
Profil de sensibilité aux antibiotiques des principaux agents
Streptococcus pneumoniae
Depuis 2002, on constate une diminution de la proportion de souches de S. pneumoniae de sensibilité diminuée aux bêta-lactamine. En 2008, elle était de 31 % pour la pénicilline, 16 % pour l’amoxicilline et 8 % pour le céfotaxime ou la ceftriaxone.
Neisseria meningitidis
En 2005, toutes les souches isolées sont sensibles aux C3G injectables (céfotaxime, ceftriaxone) et 30 % présentent une sensibilité diminuée à la pénicilline G.
La résistance à la rifampicine ou à la ciprofloxacine est rare.
Autres examens biologiques
Pour poser le diagnostic de méningite, l’analyse du LCR est obligatoirement associée à une voire plusieurs hémocultures afin d’augmenter les chances d’obtenir en culture l’agent pathogène, notamment en cas de bactéries fragiles comme le méningocoque.
De surcroît, le dosage de la procalcitonine sérique permet de différencier les méningites virales et bactériennes (voir Paramètres biochimiques utiles au diagnostic)
Une numération et formule sanguine sont également indiquées, une leucopénie est considérée comme un critère de gravité.