Les mycobactéries tuberculeuses sont très pathogènes, les mycobactéries atypiques résistent souvent aux antituberculeux, il est donc important, dans un premier temps, de distinguer ces deux groupes de mycobactéries.
Autrefois, cette distinction se faisait sur les caractères phénotypiques. Nous vivons actuellement une période de transition au cours de laquelle des tests antigéniques et moléculaires remplacent au fur et à mesure les méthodes d’identifications conventionnelles basées sur les caractères phénotypiques.
Les sondes, monobrin d’ADN capable de reconnaître et de s’hybrider à des séquences nucléiques spécifiques, ont amené un progrès considérable dans les possibilités d’identification des mycobactéries.
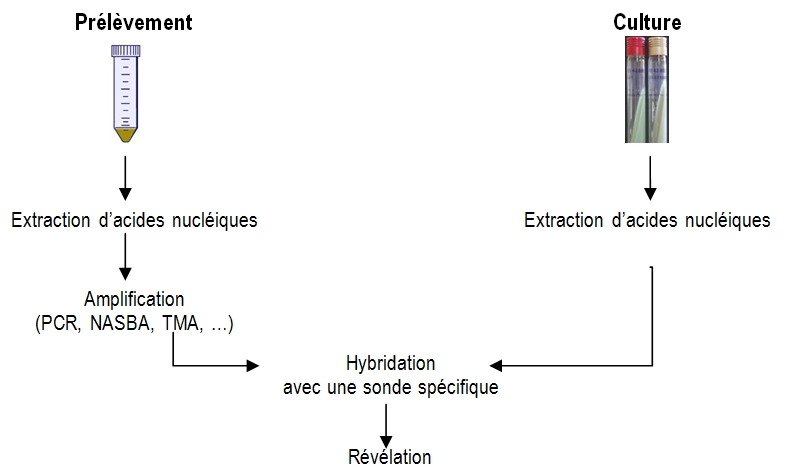
Pour que l’hybridation s’accompagne d’un signal détectable, il faut obtenir suffisamment de copies de la séquence nucléique cible.
Il existe pour cela deux possibilités :
- rechercher les séquences cibles après amplification génique directement dans le prélèvement : le diagnostic peut être alors très rapide.
- rechercher les séquences cibles après culture ; la cible est alors en quantité suffisante et l’amplification génique n’est pas nécessaire (exemple : hybridation en milieu liquide : Accuprobe).
Fig. 15 Étapes préalables aux tests de biologie moléculaire
Identification du complexe tuberculosis sans culture et après amplification génique
Ces tests sont précieux pour identifier rapidement les mycobactéries tuberculeuses.
Leur sensibilité dépend de la richesse en mycobactéries du prélèvement :
- sensibilité de 90 à 100% si l’examen direct est positif ;
- sensibilité qui varie entre 50 et 70% si l’examen direct est négatif.
En conséquence, on ne réalise en général ces tests seulement lorsque l’examen direct est positif ou bien s’il y a une forte suspicion de tuberculose pulmonaire.
Quel que soit le résultat il faut toujours réaliser des cultures pour une identification précise de l’espèce et pour faire son antibiogramme.
| En cas de résultat négatif, ne jamais conclure à une absence de bactéries tuberculeuses. |
Exemple 1 : Test Genoquick MTB (Biocentric)
La fiche technique et un schéma du principe de ce test sont présentés à la page Test Genoquick MTB (Biocentric)
Commercialisé depuis 2010, ce test permet de détecter les souches appartenant au complexe tuberculosis à partir d’échantillons d’origine respiratoire et d’urine.
La procédure comporte 3 phases :
- une extraction d’ADN à partir des échantillons décontaminés de patients (kit Genolyse) (30 min) ;
- suivi d’une amplification multiplex à l’aide d’amorces différemment marquées (R1 et R2 sur le schéma) (3 h) ;
- puis d’une détection des amplicons sur une bandelette (10 min).
On amplifie par PCR, une séquence spécifique du complexe tuberculosis et une séquence commune aux bactéries. Juste après leur formation, les amplicons simple brin s’hybrident avec des sondes spécifiques contenues dans le mélange amorces/nucléotides. Ces sondes sont marquées par un fluorophore.
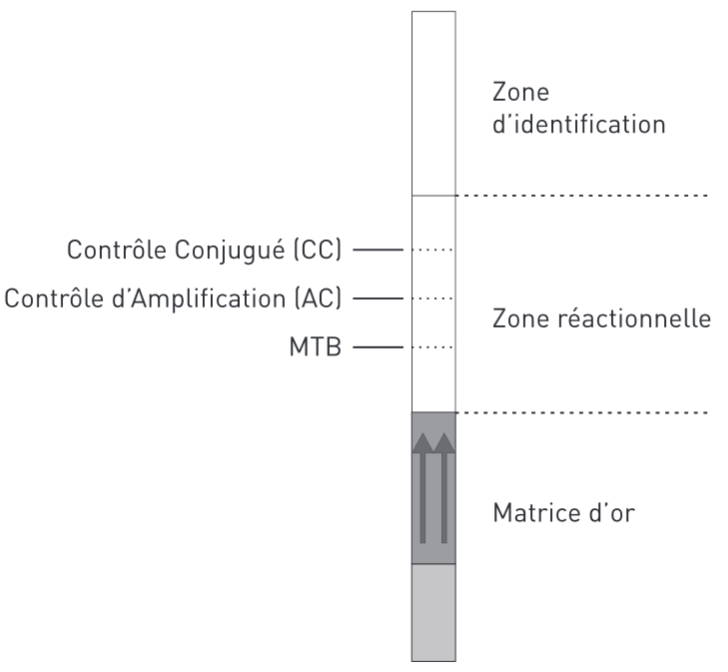
La révélation des amplicons se fait avec une bandelette présentant :
- dans la zone de dépôt de l’échantillon, une matrice contenant des anticorps de souris anti fluorophore marqués à l’or colloïdal ;
- dans la zone de lecture des sites de fixations spécifiques capables de reconnaître les marqueurs fixés aux amorces.
En pratique, on immerge l’extrémité de la bandelette dans une solution contenant les hybrides amplicon-sonde.
Le mélange migre par capillarité emportant avec lui les anticorps libres et ceux fixés aux hybrides amplicon-sonde jusqu’à être capturés au niveau des sites de liaison spécifique.
Cette capture se traduit par une bande visible sur la bandelette. Des bandes colorées peuvent apparaître à 3 niveaux :
- la zone « CC » (contrôle conjugé) doit présenter une bande. Elle permet de s’assurer de l’efficacité du conjugué et de la migration. Elle contient des anticorps anti anticorps de souris.
- la zone « AC » (contrôle d’amplification) doit présenter une bande. Cela exclut toute erreur durant les phases de pré-amplification et d’amplification, ainsi que la présence d’inhibiteurs de la taq polymérase. Il contient un site de fixation au marqueur fixé sur les amorces (R2 sur le schéma) reconnaissant une séquence d’ADN commune aux bactéries.
- la zone « MTB » est la zone permettant de détecter la présence dans l’échantillon d’une séquence spécifique au complexe tuberculosis. Il contient un site de fixation au marqueur fixé sur les amorces (R1 sur le schéma) reconnaissant une séquence d’ADN spécifique aux mycobactéries du complexe tuberculosis.
Performances
La sensibilité atteint 95-100% lorsque l’examen microscopique est positif, mais n’est en revanche que de 50-70% pour les prélèvements respiratoires lorsque l’examen microscopique est négatif.
Il est donc réservé aux seuls prélèvements présentant des BAAR. Éventuellement on le pratiquera lorsqu’un faisceau d’éléments oriente vers une tuberculose.
Sa spécificité est en revanche excellente, proche de 100%.
Exemple 2 : Test GenoType® Mycobacteria Direct (Biocentric) = NASBA + hybridation inverse
Ce test identifie à la fois les mycobactéries appartenant au complexe tuberculosis et les mycobactéries non tuberculeuses les plus fréquentes. Il est présenté à la page Test GenoType® Mycobacteria Direct.
Identification du complexe tuberculosis à partir d’une culture
Par détection d’un antigène
Exemple : Le test TBc ID® de Becton Dickinson (Fig.16)
Ce test utilise une immunochromatographie pour mettre en évidence la protéine MPT64, protéine uniquement présente chez les espèces du complexe tuberculosis (sauf le BCG)
Il ne peut être utilisé directement à partir du prélèvement, il nécessite une culture sur milieu solide ou liquide.
L’échantillon (par exemple 100 µL d’une culture en bouillon MGIT) est déposé dans un puits contenant des anticorps de souris anti-MPT-64 marqués à l’or colloïdal. Les anticorps MPT 64 et les éventuels complexes vont ensuite migrer. Au niveau de la ligne test, la capture par des anticorps anti MPT-64 immobilisés des complexes se matérialise par une ligne rose. La ligne de contrôle présente des anticorps anti anticorps de souris et permet de s’assurer de la bonne migration. Le schéma du principe de ce test est présentée à cette page : Schéma du principe du test TBc ID®
 Fig.16 : test TBc ID® Fig.16 : test TBc ID® |
Par biologie moléculaire
Exemple : le système Accuprobe®
Cette méthode, qui ne nécessite pas de PCR préalable, ne peut être appliquée directement sur le prélèvement. Elle est réalisable seulement sur des cultures pures en milieu solide ou en milieu liquide (à partir du culot de centrifugation).
Les sondes disponibles sont spécifiques des bacilles tuberculeux, sans pouvoir cependant les différencier.
La région cible reconnue par les sondes est située au niveau de l’ARNr16S (système Accuprobe®, GenProbe-BioMérieux).
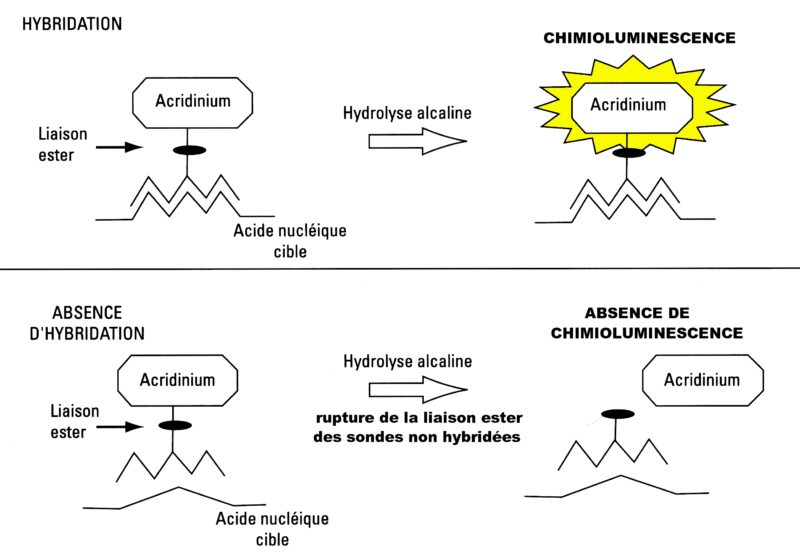
Les sondes sont marquées à l’ester d’acridinium.
Après une phase permettant l’hybridation, on ajoute de la soude au mélange réactionnel. La soude rompt seulement les liaisons ester entre l’acridinium et les sondes non hybridées. L’acridinium libre n’est plus chimioluminescent. Ainsi, seules les sondes hybridées avec la région cible donnent un signal chimioluminescent.
C’est une méthode HPA : Hybridization Protect Assay (Fig. 17)
Fig.17 : Principe de la méthode Hybridization Protect Assay
Ce test ne différencie pas les espèces du complexe tuberculosis entre elles.
Cette méthode allie une très bonne sensibilité à une très bonne spécificité. Elle s’effectue en deux heures et permet de déterminer précocement que la souche isolée appartient au complexe tuberculosis. La réponse peut être rapidement rendue et le traitement mis en oeuvre.
Gen-Probe commercialise également des sondes permettant d’identifier :
- le complexe aviaire avec distinction de M. avium et M.intracellulare
- M. kansasii
- M. gordonae
Les différentes étapes :
- Extraction de l’ADN : 100 µL de réactif de lyse + 100 µL de tampon d’hybridation + une anse de culture (ou culot d’une culture en milieu liquide) et traitement aux ultra-sons pendant 15 min afin de rompre la paroi des bactéries
- Dénaturation = bain marie pendant 10 min à 95°C
- Hybridation = 100 µL sont transférés dans un tube contenant des sondes ADN marquées et pour éviter les appariements non spécifiques, les tubes sont placés à 60°C pendant 15 min (dans un bloc chauffant)
- Sélection = on ajoute 300 µL de réactif de sélection (= la soude), incubation à 60°C pendant 5 min
- Lecture à l’aide d’un luminomètre dans l’heure qui suit.
Individualisation des espèces au sein du complexe tuberculosis
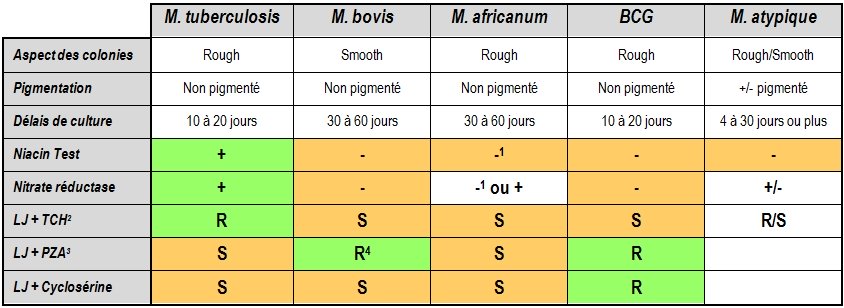
La distinction des différentes espèces du complexe tuberculosis (M. tuberculosis, M. bovis, M. africanum, BCG) est nécessaire pour des raisons épidémiologiques et de bonne utilisation des antibiotiques (M. bovis est résistant au pyrazinamide). Les méthodes phénotypiques, moins coûteuse que les méthodes de biologie moléculaire, sont les plus employées.
Méthode phénotypique
L’individualisation des espèces du complexe tuberculeux, peut s’effectuer par les techniques traditionnelles selon les critères suivants :
- caractères culturaux :
- délai d’apparition des colonies
- aspect Rough ou Smooth
- caractères biochimiques :
- niacine test
- réduction des nitrates
- profil de résistance :
- à l’hydrazide de l’acide thiophène-2-carboxylique 2 mg/L (TCH)
- à la cyclosérine 30 mg/L
- au pyrazinamide 200 mg/L (PZA).
Le test à la niacine et la recherche de la nitrate réductase son développés à la page Tests pour l’identification phénotypique des mycobactéries.
La réalisation de ces tests nécessite des cultures riches et ne peut donc s’effectuer qu’après plusieurs jours voire plusieurs semaines. Ces tests doivent être contrôlés par des témoins positifs et négatifs réalisés avec des souches de référence. L’interprétation se fera selon les résultats figurant sur le tableau 4.
Tableau 4 : Caractères phénotypiques différentiels des mycobactéries
R : résistant
S : sensible
1 En fonction du type Dakar, Yaoundé ou Rwanda, ces deux caractères peuvent varier de positif à négatif
2 LJ + TCH = milieu Loewenstein Jensen qui contient de l’acide thiophène-2-carboxylique
3 LJ + PZA = milieu Loewenstein Jensen qui contient du pyrazinamide
4 L’espèce bovis comprend 2 sous espèces : bovis bovis résistant au PZA et bovis caprae sensible au PZA
L’antibiogramme réalisé par les automates (comme le BACTEC MGIT 960) comprend une étude de la sensibilité au TCH. L’automate rend un résultat en général après 7 jours. On désigne les souches appartenant au complexe tuberculosis et résistantes au TCH comme appartenant à l’espèce Mycobacterium tuberculosis. C’est moins rapide que les méthodes d’identification par biologie moléculaire mais aussi bien moins couteux.
Méthode de biologie moléculaire
Les méthodes phénotypiques permettent de différencier les espèces mais elles sont lentes, nécessitent suffisamment de cultures et un certain nombre de variants échappent à la classification car ils ne présentent pas tous les caractères de l’espèce type.
Récemment, de nouvelles méthodes permettent de différencier les espèces du complexe tuberculosis.
Exemple : le test GenoType® Mycobacterium/MTBC (Biocentric)
La fiche technique est présentée à la page test GenoType® Mycobacterium/MTBC.
Il utilise le polymorphisme du gène gyr B. Il comporte 3 phases :
1. une extraction de l’ADN à partir de culture solide ou liquide ;
2. une PCR multiplex, à l’aide de différentes amorces biotinylées, permet d’amplifier des fragments qui appartiennent :
- au gène de l’ARN 23 S.
- au gène gyr B
- à la séquence de la délétion RD1 de Mycobacterium bovis BCG.
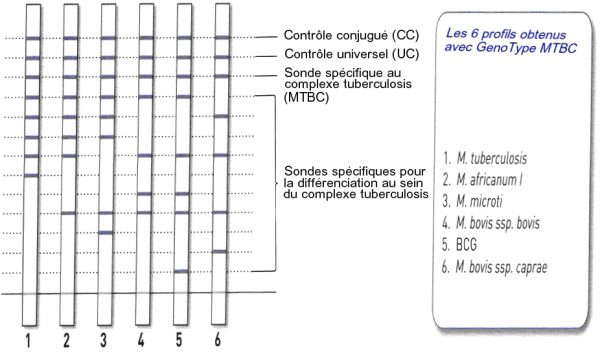
3. détection des amplicons obtenus par hybridation inverse sur une bandelette de nitrocellulose sur laquelle sont fixées au niveau de 13 régions différentes des sondes de capture spécifiques (Fig.18)
L’hybridation est révélée par le complexe streptavidine phosphatase alcaline.
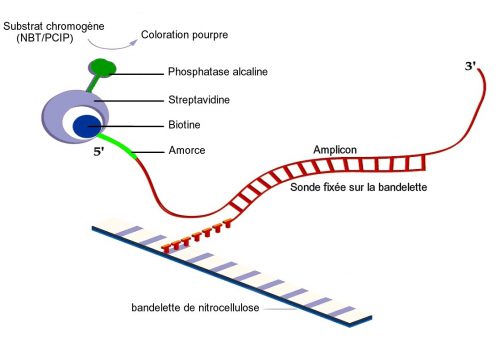
Présentation de la bandelette (Fig.19)
La bande 1 (CC = contrôle conjugué) contient de la biotine. Sa présence permet à la fois de vérifier :
- la qualité de la fixation du conjugué streptavidine – phosphatase alcaline à la biotine
- la qualité de la révélation de la phosphatase alcaline par le substrat chromogène.
La bande 2 (UC= contrôle universel) contient une sonde spécifique d’une région de l’ARN 23S amplifié commune à toutes les mycobactéries et les bactéries présentant un % G+C élevée. C’est un contrôle de l’amplification.
La bande 3 (MTBC) contient une sonde spécifique d’une région de l’ARN 23S amplifié commune à toutes les mycobactéries du complexe tuberculosis. Elle apparaît si la souche appartient au complexe tuberculosis.
Les bandes 4 à 12 contiennent des sondes reconnaissant certaines séquences du gène gyrB et permettent de différencier les espèces du complexe tuberculosis grâce au polymorphisme de ce gène : 6 profils différents existent.
La bande 13 contient une sonde spécifique de la région RD1 spécifique à M. bovis BCG.
Cette méthode en fonction de la combinaison obtenue, permet d’identifier les espèces du complexe tuberculosis à l’exception de M. africanum type II qui ne peut se différencier de M. tuberculosis.