PLAN
-
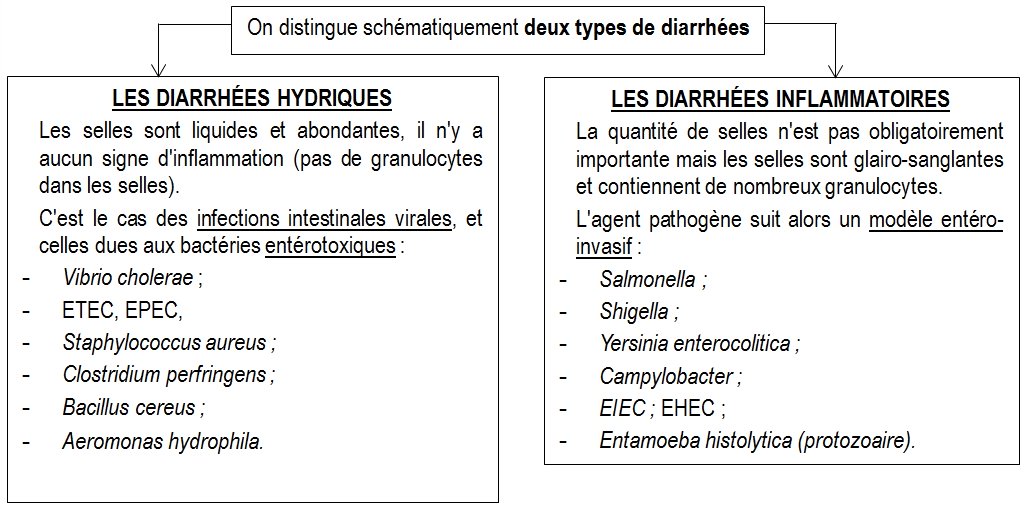
- Généralités
- Diarrhées hydriques bactériennes
- Choléra
- Turista
- Gastroentérites infantiles à EPEC
- Gastroentérites infantiles à EAggEC
- Toxinfections alimentaires à diarrhées hydriques à
- Staphylococcus aureus
- Clostridium perfringens
- Bacillus cereus
- Vibrio parahaemolyticus
- Aeromonas hydrophila
- Diarrhées inflammatoires
- Dysentérie bacillaire (Shigella, EIEC)
- Fièvres typhoïdes et paratyphoïdes
- Toxinfections alimentaires à diarrhées inflammatoires à
- Salmonella
- Campylobacter
- à Yersinia
- EHEC
- Diarrhées post-antibiotiques
- Diarrhées virales
- Diarrhéees parasitaires
- Tableaux de synthèse des différents microorganismes entéropathogènes
Généralités
Des infections toujours meurtrières
Certaines infections intestinales comme le choléra ou la dysenterie, connues depuis l’antiquité, font peur à juste titre. En effet, les diarrhées qu’elles occasionnent ont décimé les populations particulièrement en période de guerre, de famine et de catastrophes naturelles. Toutes les diarrhées ne sont heureusement pas aussi dangereuses. Ainsi la plupart sont bénignes mais restent potentiellement graves chez les sujets fragilisés notamment les nourrissons et les sujets âgés.
Chaque année, il y a environ deux milliards de cas de diarrhées dans le monde. Elles résultent la plupart du temps d’ingestion d’eaux ou d’aliments contaminés. La mortalité concerne majoritairement les enfants. En effet ils sont mal immunisés et beaucoup plus sensibles à la déshydratation sévère consécutive aux diarrhées.
Les mesures d’hygiène pour lutter contre le péril fécal
Les pays développés ont été capables de réduire très fortement l’incidence des maladies d’origine fécale par des mesures d’hygiène. Ces mesures d’hygiène sont par exemple le lavage des mains, l’installation de toilettes et de lavabos, l’utilisation du papier hygiénique, la mise en place de réseaux d’eau potable, le traitement des eaux usées, l’amélioration de l’hygiène alimentaire, la non utilisation des engrais humains en Agriculture…
Or certaines de ces mesures ont un coût souvent prohibitif pour des pays en développement. En effet, près d’un milliard de personnes sur Terre n’ont pas accès à un point d’eau potable, une pompe ou un puits protégé. De plus certains traditions culturelles comme le dépôt des matières fécales par terre et non dans une latrine favorisent les infections liées au péril fécal. Elle restent des infections très fréquentes en Afrique notamment.
Situation en France
En France, les diarrhées aiguës sont le plus souvent des Toxi-infections Alimentaires Collectives (TIAC). Elles font l’objet d’une surveillance par le Réseau Sentinelle (médecins généralistes volontaires) et leur déclaration est obligatoire. Les TIAC sont généralement consécutives aux évènements suivants seuls ou associés : erreurs dans la préparation des aliments, délai excessif entre leur préparation et leur consommation, non-respect des températures (chaînes du chaud ou du froid).
Les infections intestinales se traduisent le plus souvent par des diarrhées.
On définit une diarrhée par l’émission d’au moins trois selles non moulées par jour (poids supérieur à 300 g/j). Les diarrhées ne sont pas toutes infectieuses. Elles traduisent quelquefois des troubles de la digestion (malabsorption) ou des intolérances alimentaires. Nous développerons ici seulement les diarrhées infectieuses. Les agents pathogènes sont des bactéries, des virus ou des parasites.
Dans les pays à faible niveau d’hygiène les diarrhées infectieuses sont la cause de nombreux décès, notamment chez les enfants, par déshydratation.
Dans les pays développés :
-
-
- la plupart des infections intestinales sont des infections virales ;
- les bactéries représentent la deuxième cause, le plus souvent sous la forme de toxi-infections alimentaires ;
- les diarrhées sont quelquefois consécutives à un traitement antibiotique ;
- les diarrhées parasitaires sont surtout des cas importés.
-
DIARRHÉES HYDRIQUES BACTÉRIENNES
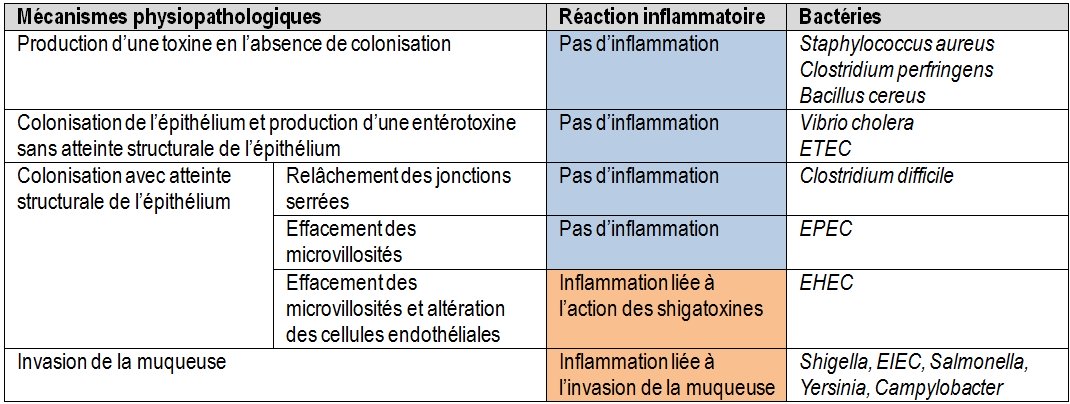
Ce sont des diarrhées aqueuses avec des selles liquides, abondantes, accompagnées souvent de nausées, de vomissements, de douleurs abdominales. Il n’y a en général pas de fièvre.
Les agents pathogènes, à l’origine de ces diarrhées, ne franchissent pas l’épithélium et ne déclenchent pas de réaction inflammatoire. Il n’y a donc pas de granulocytes neutrophiles dans les selles.
Les mécanismes physiopathologiques à l’origine des pertes hydriques observées au cours de ces diarrhées varient selon les microorganismes. Certains facteurs de pathogénicité ont été clairement identifiés mais il est probable qu’ils n’agissent pas seuls.
- Pour certaines bactéries entérotoxiques, les pertes hydriques reposent essentiellement sur la libération d’une toxine cytotonique. Cette toxine perturbe le métabolisme hydro-minéral des entérocytes (Vibrio cholerae, ETEC) ;
- Pour les EPEC et les EHEC, on constate une disparition des microvillosités des entérocytes. La conséquence est un défaut de réabsorption de l’eau.
CHOLÉRA
Manifestations cliniques
C’est la forme la plus sévère des diarrhées hydriques.
Elle débute brusquement avec une diarrhée profuse, des vomissements et douleurs abdominales. Les selles fécales au départ deviennent rapidement aqueuses et présentent un aspect caractéristique « en eau de riz », avec des grumeaux blanchâtres. Les pertes hydriques peuvent atteindre 10 à 15 litres / jour. Elles entraînent une déshydratation aiguë (30% des cas) pouvant provoquer un état de choc (10% des cas). Sans traitement, cette forme grave de choléra est mortelle. Il existe aussi (60% des cas) des formes atténuées de choléra appelées « cholérines » qui guérissent spontanément en quelques jours.
Épidémiologie
Seules les souches de Vibrio cholerae capables de sécréter la toxine cholérique sont responsables du choléra. Elles appartiennent presque exclusivement au sérogroupe O:1. Cette infection strictement humaine appelée aussi « maladie des mains sales » évolue sous forme endémo-épidémique. Depuis 1961, nous assistons à la 7ème pandémie. Elle est due à Vibrio cholerae O1 biotype El Tor. Elle sévit en Asie, en Afrique, en Amérique latine et à Madagascar. D’autres souches appartenant au sérogroupe O139 sont apparues fin 1992 en Inde et au Bangladesh. Elles font craindre une 8ème pandémie, mais elles restent pour l’instant confinées au continent asiatique.
Il y a chaque année 3 à 5 millions de cas de choléra, avec 100 000 à 120 000 décès. Les rares cas signalés en Europe sont des cas importés (retour d’un séjour dans les régions endémiques).
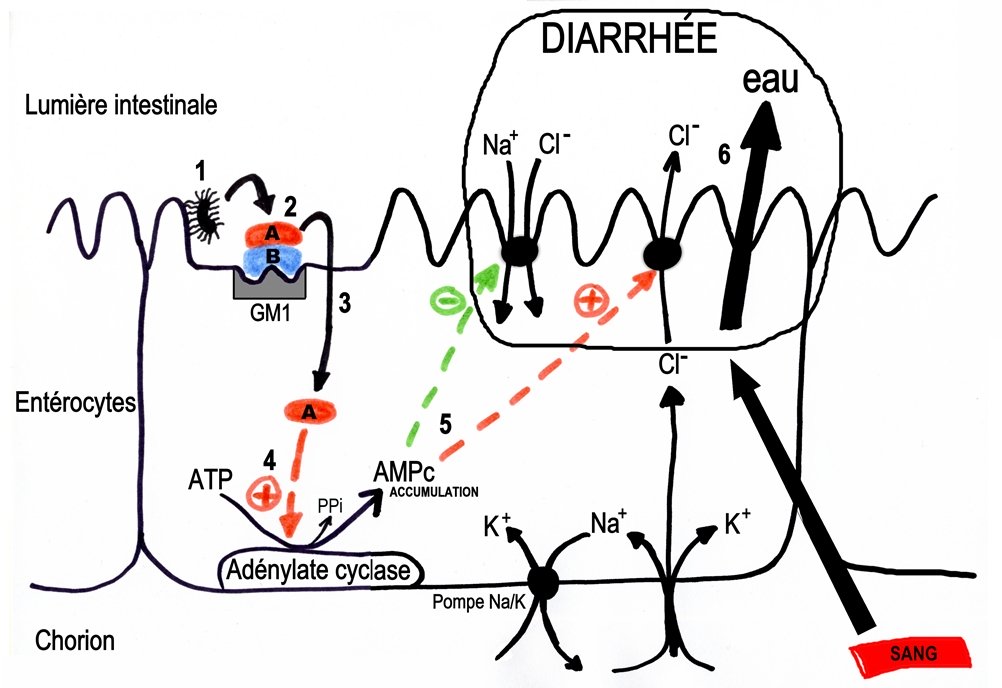
Physiopathologie du choléra
Les quelques bactéries ayant résisté à l’acidité gastrique se multiplient dans la lumière de l’intestin grêle. Ensuite elles sécrètent des enzymes leur permettant de traverser la couche de mucus tapissant la muqueuse intestinale.
Première étape : adhésion de Vibrio cholerae
Les adhésines fimbrillaires reconnaissent des récepteurs spécifiques présents à la surface des entérocytes. Ainsi elles permettent aux bactéries d’adhérer à la surface de l’épithélium (1).
Deuxième étape : action de la toxine cholérique
2. Vibrio cholerae libère alors la toxine cholérique. C’est une toxine de type A-B. Elle se fixe par sa sous-unité B sur un récepteur spécifique présent à la surface des entérocytes (ganglioside GM1).
3. La fixation de la sous-unité B permet la translocation de la sous unité A dans le cytoplasme de la cellule.
4. La sous unité A conduit à la stimulation de l’adénylatecyclase des membranes basales et latérales des entérocytes ce qui entraîne une accumulation importante d’AMPc.
(Plus précisément, la sous unité A transfère un groupement ADP-ribose sur la protéine G stimulante (Gs). Ainsi ADP ribosylée, la protéine Gs demeure continuellement sous forme active et stimule en permanence l’adénylate cyclase).
5. Cette augmentation intracellulaire d’AMPC aboutit à une perturbation des transporteurs ioniques membranaires comme le canal CFTR. En conséquence, celui-ci va laisser passer massivement des ions chlorures dans la lumière intestinale. Simultanément on observe une inhibition de l’absorption couplée des ions Na+ et Cl–. Au final, le contenu du tube digestif devient hypertonique par rapport au cytoplasme des entérocytes.
6. Selon les lois de l’osmose, l’eau passe du cytoplasme dans la lumière du tube digestif. L’eau perdue par le cytoplasme est aussitôt compensée par de l’eau provenant du chorion et du sang. La volémie puis la pression artérielle chute.
Bilan
La diarrhée résulte donc d’une hypersécrétion d’eau. La muqueuse intestinale reste intacte, le microorganisme n’a pas franchi l’épithélium intestinal, il n’y a donc pas de réaction inflammatoire.
On appelle toxine cytotonique, les toxines qui perturbent le métabolisme hydrominérale des cellules. La toxine cholérique est une toxine cytotonique.
Fig. 7 : Mécanisme physiopathologique de Vibrio cholerae O1 ou O139 et des ETEC = modèle ENTEROTOXIQUE
Traitement
L’objectif du traitement est, avant tout, de compenser les pertes d’eau et d’ions. C’est pourquoi le traitement repose essentiellement sur une réhydratation d’urgence des malades à l’aide de solutés hydroélectrolytiques.
- Pour les cas de forte déshydratation, on injecte par voie parentérale du liquide de Ringer au lactate. Il contient du Na+, K+, Ca2+, Cl–, lactate, à des concentrations égales aux concentrations plasmatiques.
- Dans le cas de déshydratation modérée, on administre par voie orale une solution préconisée par l’organisation mondiale de la santé (OMS). Sa composition, légèrement différente de la précédente, comporte du Na+, K+, Cl–, citrate et glucose.
Cette réhydratation suffit à guérir du choléra car les défenses immunitaires sont capables d’éliminer Vibrio cholerae en quelques jours.
On peut associer à cette réhydratation, un traitement antibiotique. Il présente deux objectifs : accélerer la guérison et surtout limiter la durée des portages afin d’enrayer rapidement l’épidémie. Il fait actuellement l’objet de controverses compte tenu de la fréquence croissante des souches résistantes. Les antibiotiques utilisés sont la tétracycline, l’érythromycine ou l’association TSU.
Prévention
La prévention repose essentiellement sur des mesures d’hygiène : isolement des malades, désinfection de l’environnement, distribution d’eau potable (ou faire bouillir l’eau), protection des aliments et lavage à l’eau bouillie. La vaccination anti-choléra est peu pratiquée pour deux raisons :
- elle est efficace seulement chez 50% des sujets
- la durée de la protection est inférieure à 6 mois.
TURISTA ou diarrhée du voyageur : le cas des ETEC
La turista est une gastro-entérite aiguë qui affecte les voyageurs des pays à faible niveau d’hygiène. Il s’agit essentiellement des pays situés en zones tropicale et subtropicale.
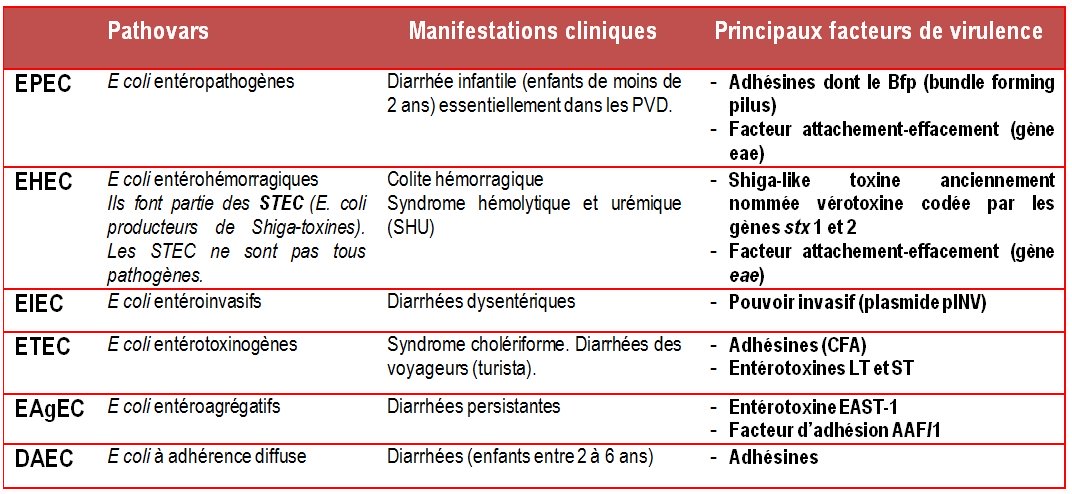
Les Escherichia coli entérotoxinogènes (ETEC) en sont la principale cause. Peu sévère en général, elle régresse spontanément en quelques jours. Les ETEC sont des pathovars d’Escherichia coli qui ont acquis des gènes plasmidiques leur conférant un pouvoir entéropathogène. Ces gènes codent pour des adhésines et des entérotoxines cytotoniques (toxines thermolabile LT et thermostable ST) dites « cholera like ». On les nomme ainso car leur structure et leur mode d’action sont très proches de celles de la toxine cholérique.
Le mécanisme physiopathologique présente de nombreuses similitudes avec celui du choléra. (Fig. 7).
GEI à EPEC (gastro-entérites infantiles à Escherichia coli entéropathogènes)
Épidémiologie
Ces GEI touchent les enfants de moins de 2 ans. Jadis responsables d’épidémies dans les crèches et les services de pédiatrie, les diarrhées à EPEC régressent nettement dans les pays industrialisés. Désormais, on ne signale que des cas isolés. Les EPEC restent cependant une cause majeure de diarrhée infantile dans les pays en voie de développement.
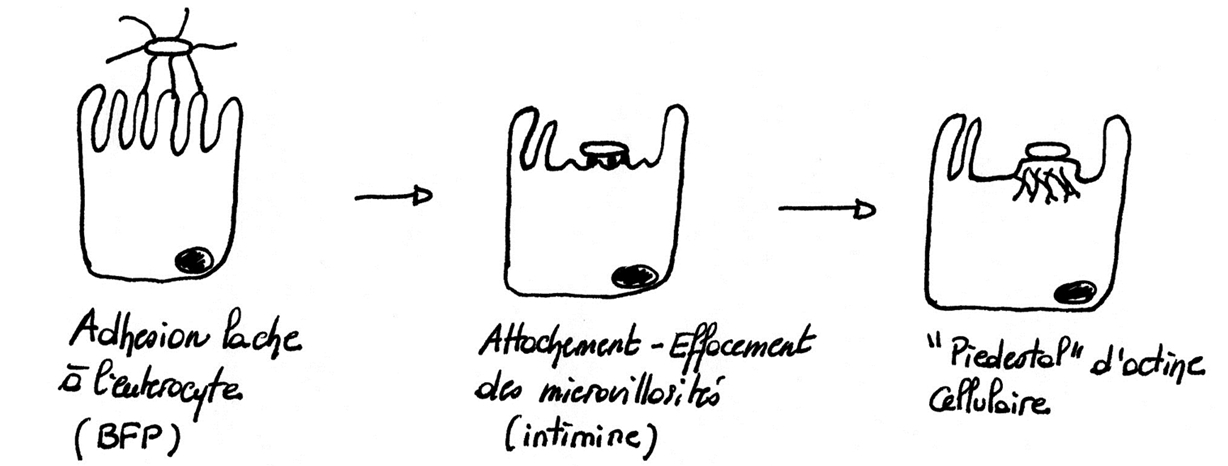
Physiopathologie des GEI à EPEC (Fig. 8)
Ces souches possèdent un facteur d’adhésion leur permettant de s’aggréger les unes aux autres sous formes d’« amas de briques » à la surface de l’épithélium intestinal. Elles sécrètent également une entérotoxine thermostable EAST-1 qui perturbe le métabolisme hydrominéral des entérocytes.
Dans un premier temps, les EPEC adhérent aux microvillosités des entérocytes grâce à une adhésine plasmidique (BFP = Bundle Forming Pilus).
Cette adhésion initiale induit un signal permettant ensuite aux bactéries d’adhérer de façon plus intime (on parle d’attachement). Cet attachement met en jeu une protéine de la membrane externe appelée intimine (codée par le gène chromosomique eae) et des récepteurs spécifiques présents à la surface des entérocytes.
Les EPEC injectent alors dans l’entérocyte différentes molécules responsables d’un réarrangement du cytosquelette qui conduit à un effacement des microvillosités. Les microvillosités sont remplacées par un réseau d’actine cellulaire formant un « piédestal » sous les bactéries. La disparition des microvillosités entraîne une diminution de la surface d’échange entre l’entérocyte et la lumière intestinale. La diarrhée s’explique par un défaut de réabsorption de l’eau.
Fig. 8 : Lésions « d’attachement – effacement » des EPEC
GEI à EAggEC (gastro-entérites infantiles à Escherichia coli entéroagrégatifs)
Les EaggEC sont responsables de diarrhées infantiles semblables à celles des EPEC mais qui durent plus longtemps. Ces diarrhées dites persistantes sévissent dans les pays en voie de développement.
Toxi-infections alimentaires à diarrhées HYDRIQUES
Une toxi-infection alimentaire collective (TIAC) se définit comme la survenue d’«au moins deux cas groupés, d’une symptomatologie similaire, en général digestive, dont on peut apporter la cause à une même origine alimentaire ».
Les TIA peuvent entrainer des diarrhées hydriques ou inflammatoires.
Nous présenterons dans ce chapitre seulement les TIA d’origine bactérienne et se traduisant par des diarrhées hydriques.
Dans le cas présent, une toxine est généralement responsable des troubles. La production de cette toxine se fait :
- soit dans l’aliment ingéré, on parle d’intoxination. C’est le cas pour les TIA à Staphylococcus aureus, Bacillus cereus.
- ou bien in vivo. C’est le cas pour les TIA à Clostridium perfringens, Bacillus cereus, Vibrio parahaemolyticus, Aeromonas hydrophila
TIA à Staphylococcus aureus
Elles font suite à l’ingestion d’aliments contaminés par une souche de Staphylococcus aureus entérotoxinogène. C’est une intoxination. C’est lors de la préparation des aliments qu’on contamine le prélèvement. L’aliment est contaminé par un porteur sain (50 % de porteurs au niveau du nez ou de la gorge) ou par un personnel ayant une plaie infectée par ce microorganisme (furoncle, panaris). Produits laitiers ou carnés sont souvent mis en cause. Lorsqu’on abandonne ces aliments plusieurs heures à une température de 20 à 30 °C, les staphylocoques s’y multiplient et produisent une entérotoxine. Il existe diverses entérotoxines. Ces entérotoxines sont thermostables. Par exemple, l’entérotoxine A résiste 3 heures à 100°C et 10 à 40 minutes à 120°C. En outre, elle résiste également aux enzymes digestives et à l’acidité gastrique. La toxine étant thermostable, une cuisson est souvent insuffisante pour neutraliser la toxine.
Seules certaines souches de Staphylococcus aureus sécrètent une entérotoxine. Ces souches sont lysogénisées, c’est à dire que le gène de ces toxines est apporté par un bactériophage.
Il semblerait que ces toxines agissent comme des superantigènes, les troubles observés seraient consécutifs à une réaction anormale du système immunitaire, elles n’agiraient donc pas directement sur les entérocytes (le terme entérotoxine apparaît ainsi discutable). Les symptômes apparaissent brutalement (délai d’incubation inférieur à 2 heures) : nausées, douleurs abdominales et surtout vomissements violents et répétés souvent accompagnés de diarrhée. Il n’y a généralement pas de fièvre.
TIA à Clostridium perfringens
En règle générale, ces toxi-infections s’observent après l’ingestion de viandes cuites à l’eau. La température dans la zone centrale du bloc de viande est quelquefois insuffisante pour détruire les spores formées par le microorganisme. Cette zone se refroidissant beaucoup plus lentement que la périphérie, la température se maintient assez longtemps dans des limites favorisant la germination des spores et la multiplication des formes végétatives. On observe une toxi-infection lorsque les aliments ont une teneur en Clostridium perfringens qui dépasse 106 microorganismes/g. Cette valeur s’atteint rapidement quand on conserve mal l’aliment après la cuisson. Dans ce cas, l’ingestion d’un grand nombre de C. perfringens permet son implantation dans l’intestin grêle, il s’y multiplie puis au cours de la sporulation produit l’entérotoxine.
L’entérotoxine forme des pores dans la membrane cytoplasmique des entérocytes, provoquant une fuite d’eau et d’électrolytes. Notons qu’un petit nombre seulement de souches de Clostridium perfringens sécrètent une entérotoxine. Les symptômes apparaissent généralement 10-12h après l’ingestion du repas contaminant. Ils se traduisent surtout par de la diarrhée et de violents maux de ventre, parfois de nausées. Les vomissements et la fièvre ne sont pas habituels. Le plus souvent, cette affection guérit spontanément en 2-3 jours.
TIA à Bacillus cereus
Il s’agit très souvent de l’ingestion d’aliments conservés hors du réfrigérateur après une cuisson (riz, purées et légumes germés ont pu être incriminés). Bacillus cereus est à l’origine de deux types de TIA :
- une TIA avec principalement un syndrome diarrhéique qui fait suite à l’ingestion de grande quantité de microorganismes (106 à 109/g). Les bactéries produisent dans l’intestin des entérotoxines à l’origine des troubles. Après un délai d’incubation de 8 à 16 heures, les malades souffrent de diarrhées, accompagnés de douleurs abdominales, de nausées, parfois de fièvre ;
- une TIA avec principalement un syndrome émétique, suite à l’ingestion d’aliment dans lequel, au cours de sa multiplication, Bacillus cereus a sécrété une toxine émétisante appelée céréulide. C’est ainsi une intoxination. Comme l’entérotoxine staphylococcique, cette toxine est thermostable et n’est donc pas détruite par une deuxième cuisson de l’aliment. Le délai d’incubation est ici plus court (1 à 5 heures). La maladie se traduit dans un premier temps par des vomissements quelquefois suivis de diarrhées.
TIA à Vibrio parahaemolyticus
Les TIA à Vibrio parahaemolyticus font souvent suite à la consommation de poisson et de fruits de mer crus ou insuffisamment cuits. Ces TIA rares en Europe sont très fréquentes au Japon.
Les symptômes sont des douleurs abdominales, crampes, diarrhées aqueuses ; des nausées, des vomissements et quelquefois de la fièvre. La maladie est souvent bénigne.
Une toxine produite dans l’intestin est responsable des troubles.
TIA à Aeromonas hydrophila
Il est responsable de gastro-entérites secondaires à l’ingestion d’eau douce non traitée ou à une contamination alimentaire (viandes, crudités, crèmes glacées). Ces gastro-entérites sont bénignes. Elles se manifestent généralement par de brefs épisodes de diarrhée hydrique, plus exceptionnellement par une diarrhée sanglante prolongée.
DIARRHÉES INFLAMMATOIRES BACTÉRIENNES
Les agents pathogènes, à l’origine de ces diarrhées, franchissent l’épithélium et déclenchent une réaction inflammatoire. Par conséquent, les selles contiennent de nombreux granulocytes neutrophiles. Dans la plupart des cas, les diarrhées s’expliquent par un défaut de réabsorption de l’eau, les entérocytes étant détruits.
Dysenterie bacillaire
On distingue deux types de dysenterie :
- la dysenterie amibienne, causée par une amibe pathogène, Entamoeba histolytica sera traitée avec les autres diarrhées parasitaires (Cf. 3.5).
- la dysenterie bacillaire causée par Shigella spp ou les EIEC.
La dysenterie bacillaire se traduit par un syndrome dysentérique. Ce syndrome se caractérise par un début brutal, une fièvre élevée, des diarrhées liquides, muco-sanglantes, parfois purulentes avec douleurs abdominales. L’observation de nombreux granulocytes neutrophiles dans les selles, signe d’une réaction inflammatoire souvent intense, oriente le diagnostic vers une diarrhée à microorganismes invasifs.
Shigelloses
Les quatre espèces de Shigella sont entéropathogènes et il suffit de quelques bactéries pour entraîner une diarrhée.
Les souches de Shigella dysenteriae sérotype 1 (ou bacille de Shiga), essentiellement rencontrées dans les pays à faible niveau d’hygiène, sont les seules à sécréter une toxine (Shiga-toxine) et sont responsables d’épidémie brutale avec les symptômes les plus sévères. Chaque année, elle tue plusieurs centaines de milliers d’individus dans le monde, pour l’essentiel des enfants de moins de 5 ans.
Shigella flexneri est responsable de la forme endémique de la maladie dans ces pays.
En France, les infections sont moins graves et essentiellement dues à Shigella sonnei et Shigella flexneri. Le nombre de cas estimé en France est d’environ 2000 par an. Elles surviennent surtout dans les collectivités où existent des problèmes d’hygiène et au cours d’épidémies familiales.
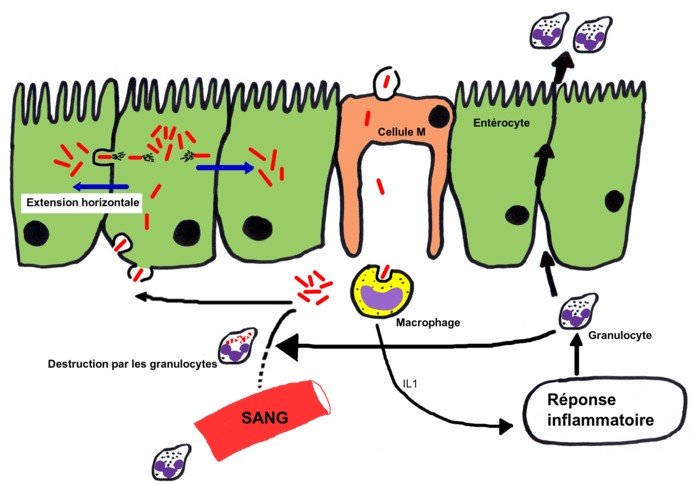
Physiopathologie des shigelloses (Fig. 9)
Les Shigella ne sont pas capables de pénétrer dans les entérocytes par leur face apicale mais par leur face latéro-basale là où se trouvent leurs récepteurs spécifiques. Pour rejoindre cette région les bactéries traversent l’épithélium intestinal via les cellules M et sont alors phagocytées par les macrophages du tissu lymphoïde sous-jacent.
Dans les macrophages, elles échappent à la digestion lysosomiale grâce à leur protéine Ipa b qui permet de rompre très rapidement la membrane du phagosome avant la fusion phagolysosomiale. Elles sont alors libres dans le cytoplasme des macrophages.
Elles induisent l’apoptose des macrophages ainsi qu’une intense réaction inflammatoire. Les Shigella pénètrent ensuite à l’intérieur des entérocytes grâce à un mécanisme de phagocytose induite : elles se fixent, via une protéine présente à leur surface (invasine), sur un récepteur spécifique de l’entérocyte (intégrine) et cette adhésion déclenche un remaniement du cytosquelette de l’entérocyte lui permettant de phagocyter la bactérie. Les Shigella lysent rapidement le phagosome se retrouvent libres dans le cytoplasme de l’entérocyte et vont très rapidement s’y multiplier et se déplacer en polymérisant de l’actine cellulaire. La formation de ces «comètes» d’actine permet le passage direct de la bactérie d’une cellule infectée à une cellule saine contiguë, on parle d’extension horizontale de l’infection.
Bilan
Les entérocytes sont ainsi au fur à mesure détruits avec pour conséquence un défaut d’absorption des liquides.
La diarrhée résulte de l’inhibition de l’absorption des liquides (liée à la destruction de la muqueuse)
Les granulocytes neutrophiles détruisent les Shigella présentes dans le chorion, ce qui empêche toute progression verticale des bactéries, ainsi elles ne passent que très rarement dans le sang. Ainsi généralement les coprocultures sont positives, avec présence de pus, de glaires, parfois de sang et les hémocultures restent généralement négatives.
Les souches de S. dysenteriae sérotype 1 produisent en outre une cytotoxine (appelée Shiga-toxine) qui altère les vaisseaux sanguins de la muqueuse intestinale. Son mode d’action est présenté avec les TIA à EHEC (3.1.4).
Fig. 9 : modèle d’invasion par Shigella
Escherichia coli entéro invasifs (EIEC)
Ils provoquent des diarrhées épidémiques de type dysentérique dans les pays en voie de développement. Leur pathogénèse est similaire à celui de Shigella spp (invasion des entérocytes, mobilité intracytoplasmique liée la formation de comètes d’actine, forte inflammation et destruction de l’épithélium intestinal).
Ils ne produisent pas de toxine de Shiga comme S. dysenteriae 1.
Fièvres typhoïdes et paratyphoïdes
Nomenclature
| *Le genre Salmonella comprend 3 espèces : enterica, bongori et subterranea. L’espèce principale est Salmonella enterica qui comprend 6 sous espèces dont la plus fréquente est la sous espèce enterica, cette dernière se subdivisant en de très nombreux sérovars (enteritidis, typhimurium, typhi, hadar…). Pour simplifier l’écriture de ces différents pathogènes, on remplacera, par exemple : Salmonella enterica sous espèce enterica sérotype typhi = Salmonella Typhi (le sérotype n’étant pas écrit en italique et son nom commence par une majuscule). |
Épidémiologie
Les fièvres typhoïdes et paratyphoïdes sont des bactériémies d’origine lymphatique provoquées par des sérotypes de Salmonella strictement humains : Salmonella Typhi, Salmonella Paratyphi A, B, C.
La maladie est donc à transmission interhumaine : l’homme se contamine en ingérant de l’eau ou des aliments souillés par les selles de malades ou de porteurs sains. Les malades présentent une forte fièvre avoisinant les 40°C et des migraines persistantes. La diarrhée n’apparait qu’au cours de la 2ème ou 3ème semaine. Les bactéries présentes dans le sang peuvent infecter d’autres organes comme la vésicule biliaire et l’intestin grêle dont la paroi peut se perforer et causer des hémorragies intestinales.
Elle se rencontre surtout dans des zones à conditions d’hygiène précaire, frappant principalement les pays en voie de développement en Asie, en Afrique ou en Amérique Latine. On dénombre 20 millions de cas et 200 000 décès par an. Elle touche essentiellement l’adolescent et l’adulte.
La fièvre typhoïde est devenue rare dans les pays industrialisés du fait des progrès de l’hygiène et de l’amélioration des conditions d’approvisionnement en eau potable. En France, la fièvre typhoïde est une maladie à déclaration obligatoire. On déclare une centaine de cas chaque année en France métropolitaine, dont environ 90 % contracté au cours d’un séjour en zone d’endémie.
Physiopathologie
Contrairement aux Shigella, les Salmonella ont le choix, elles peuvent traverser l’épithélium en passant par les cellules M ou bien par les entérocytes.
Elles sont phagocytées par les macrophages des follicules lymphoïdes, s’y multiplient dans un premier temps puis rejoignent les ganglions mésentériques.
- Si elles y sont détruites, l’infection reste localisée et n’atteint pas le stade de la bactériémie (coproculture positive et hémoculture négative).
- Dans le cas inverse les Salmonella sont véhiculées par la lymphe et rejoignent la circulation sanguine. Elles sont alors responsables d’un épisode bactériémique (coproculture et hémoculture positives).
Dans tous les cas, la lyse massive des Salmonella libère l’endotoxine responsable de la forte fièvre et des troubles neurologiques.
Prophylaxie
La prophylaxie repose essentiellement sur la vaccination. Deux types de vaccins sont actuellement sur le marché :
- vaccin vivant atténué Ty21 a, oral, dans les régions d’endémie,
- vaccin inerte fractionné : Typhim Vi® (Aventis Pasteur) et Typherix® (Olaxo Smith Kline), il entraîne une protection rapide et durable (3 ans), y compris dans les zones hyper-endémiques; il est bien toléré
Ces vaccins protègent seulement contre S. Typhi. II faut y associer la lutte contre le péril fécal.
Toxi-infections alimentaires à diarrhées inflammatoires
Ce sont des diarrhées banales avec douleurs abdominales associées à des vomissements et parfois de la fièvre. Les microorganismes en cause sont les sérotypes ubiquitaires de Salmonella enterica, les Campylobacter, les Yersinia et les Shigella.
TIA à Salmonella
Les Salmonella représentent la première cause de TIAC avec une estimation de 163 foyers/an affectant environ 1200 personnes en France (foyers confirmés ou suspectés entre 2006 et 2008). Ces salmonelloses sont dues à des sérotypes ubiquitaires (qui infectent aussi bien l’homme que les animaux). En France la plupart des souches isolées appartiennent aux sérotypes Typhimurium et Enteritidis. D’autres sérotypes émergent puis régressent (exemples : S. Hadar, S. Virchow, S. Infantis). Chez l’adulte en bonne santé, seule une ingestion massive peut provoquer l’infection. Cela suppose une multiplication dans l’aliment et donc une mauvaise conservation. Les aliments incriminés sont les œufs et préparations à base d’œufs peu cuits, les laitages, la viande crue ou peu cuite. La plupart des TIAC à salmonelles sont survenues dans le cadre de repas familiaux.
La durée d’incubation est de 12 à 24 heures. Les malades présentent de la fièvre et souffrent de diarrhées, de vomissements, de douleurs abdominales. La maladie dure le plus souvent entre 2 et 5 jours et les sujets guérissent spontanément (sans traitement antibiotique).
Chez les sujets immunodéprimés, personnes âgées et jeunes enfants, un traitement antibiotique est quelquefois nécessaire.
La physiopathologie de ces salmonelloses est mal connue. A l’inverse des Salmonella responsables des fièvres typhoïdes et paratyphoïdes, elles ne passent que très rarement dans le sang (les quelques cas de bactériémies positives concernent les sujets immunodéficients).
TIA à Campylobacter
Selon certains auteurs, ils seraient responsables de la majorité des diarrhées d’origine bactérienne.
Leur fréquence en France est probablement sous-estimée du fait de l’absence de coproculture dans beaucoup d’épisodes diarrhéiques.
Les espèces les plus fréquemment isolées de selles en France sont Campylobacter jejuni (85%), C. coli (10%), C. fetus (4%) et Arcobacter butzleri (1%). Elles sont transmises par l’alimentation, principalement la viande de volaille (consommation de viande insuffisamment cuite mais surtout contamination croisée dans la cuisine avec des aliments crus).
Peu d’éléments cliniques permettent de différencier l’entérite des Salmonella de celle des Campylobacter. La gravité est souvent moindre, la fièvre moins élevée. Un élément est cependant caractéristique de C. jejuni : c’est la présence de sang ou de mucus dans les selles après une diarrhée aqueuse.
On connait mal leur mécanisme physiopathologique.
Les campylobacters intestinaux peuvent, par translocation, passer dans le sang ; c’est le cas surtout pour C. fetus qui a une forte résistance au pouvoir bactéricide du sérum.
Certains sérotypes de Campylobacter jejuni ont été tenus responsables de complications post infectieuses, la plus grave étant le syndrome de Guillain-Barré. C’est une maladie auto-immune inflammatoire du système nerveux périphérique qui se manifeste par une paralysie progressive et ascendante. Elle s’expliquerait par une parenté entre certains antigènes de Campylobacter jejuni et certains gangliosides, présents dans le système nerveux.
TIA à Yersinia
Deux espèces sont entéropathogènes : Yersinia enterocolitica, de loin la plus fréquente (95% des Yersinia envoyées au CNR des Yersinia en 2007) et Yersinia pseudotuberculosis. Les diarrhées à Yersinia enterocolitica se manifestent surtout sous forme de cas sporadiques ou de petites épidémies familiales et prédominent chez l’enfant de moins de 10 ans. Elles sont en général bénignes et se traduisent par des diarrhées, une fièvre et des douleurs abdominales souvent modérées.
Comme la recherche des Yersinia n’est pas systématique dans de nombreux LBM, il semblerait que leur incidence soit fortement sous-estimée (BEH du 13 juillet 2010/N°29)
Le réservoir est principalement animal (porcs, bovins, caprins).
Sur des terrains débilités, des complications sont possibles (polyarthrite réactionnelle, érythème…). Y. enterocolitica est capable de se multiplier entre 4 et 8°C ce qui explique l’augmentation de sa prévalence avec l’avènement des chaînes de froid.
Pour s’assurer du caractère entéropathogène des souches de Yersinia enterocolitica, il est primordial d’identifier le biotype. En effet, seuls certains biotypes porteurs d’un plasmide de virulence (pYV) sont pathogènes pour l’homme (biotypes 1B, 2, 3, 4 et 5).
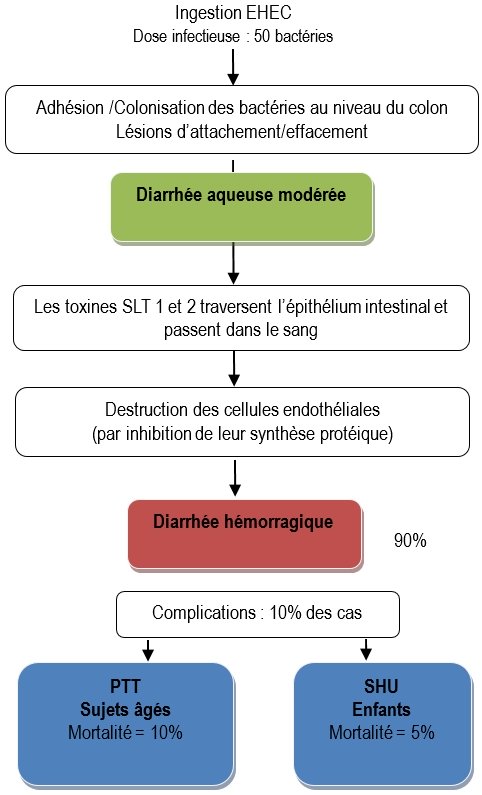
TIA à EHEC (Escherichia coli entérohémorragiques) ou STEC (Shiga-toxin-producing Escherichia coli).
Épidémiologie
Ces pathovars d’Escherichia coli ont d’abord été isolés de colites hémorragiques épidémiques chez des enfants américains contaminés par de la viande de bœuf mal cuite (« maladie du hamburger »). Toutes les souches isolées appartenaient au sérotype O157 : H7. La diarrhée sanglante, non purulente et non fébrile (d’aspect donc différent des diarrhées dues aux EIEC et aux EPEC) peut évoluer vers des pathologies plus graves : le syndrome hémolytique et urémique (SHU) avec risque d’insuffisance rénale et le Purpura Thrombotique et Thrombocytopénique (PTT) correspondant à des atteintes neurologiques graves.
Depuis, d’autres sérotypes ont été incriminés dont O111, O26, O80, O103, O145…..
Les EHEC se transmettent principalement par voie alimentaire (viande de bœuf mais aussi de porc, de cerf, lait non pasteurisé, eau) par contact interhumain et par contact avec des ruminants contaminés (essentiellement les bovins). En France la première épidémie a eu lieu en Aquitaine en 2005, ce sont des steaks hachés surgelés qui en étaient la cause. Il existe aussi des cas sporadiques mais comme les EHEC ne sont pas recherchés en routine dans les selles des patients diarrhéiques leur fréquence est probablement sous-estimée. Ce sont les enfants de moins de 5 ans et les personnes âgées qui sont le plus à risque.
Physiopathologie des infections à EHEC
La virulence des EHEC est due à la production de toxines appelées Shiga Like Toxines en raison de leur similitude avec la toxine produite par Shigella dysenteriae. Ces toxines, présentant un pouvoir cytotoxique sur des cultures de cellules Véro (provenant d’épithélium de rein de singe vert d’Afrique), sont aussi appelées vérotoxines. Il existe deux types de Shiga-toxines : Stx1 et Stx2, codées par un bactériophage porteur de l’opéron stx.
Ces toxines diffusent dans tout l’organisme et sont responsables de lésions hémorragiques. Elles se fixent sur un récepteur Gb3 présent principalement à la surface des cellules endothéliales. Ensuite elles bloquent la sous-unité 60S des ribosomes. En conséquence, la synthèse des protéines s’arrête et entraine la destruction des cellules cibles.
Les cellules endothéliales tapissant les vaisseaux sanguins de la muqueuse intestinale, des reins et du système nerveux central sont les plus riches en récepteurs Gb3 et donc les principales cibles.
Dénomination STEC/EHEC
Toutes les souches d’Escherichia coli porteuses de gènes codant une Shiga-toxine ont actuellement la dénomination de STEC ou VTEC (Shiga-toxin-producing Escherichia coli, Vérotoxic Escherichia coli).
Les STEC ne sont pas tous entéropathogènes, ceux qui le sont correspondent aux EHEC.
Les EHEC possèdent d’autres facteurs de pathogénicité comme l’intimine codée par le gène eae (comme les EPEC) qui est responsable des lésions d’attachement-effacement des microvillosités des entérocytes (voir figure 8) ainsi qu’une entérohémolysine qui en lysant les hématies libère du fer, ce qui permettrait un meilleur développement des bactéries. Le rôle de cette toxine dans la pathogénicité des EHEC est encore discuté.
Fig. 11 : Physiopathologie des infections à EHEC
Les difficultés d’une classification
La classification très schématique des diarrhées (hydriques ou inflammatoires) ne permet pas de positionner aisément les EHEC. Ce ne sont pas vraiment des bactéries invasives car incapables de résister à l’action bactéricide des macrophages comme le font par exemple les Shigella et les EIEC. Mais les shigatoxines en altérant les cellules endothéliales des capillaires intestinaux déclenchent une légère réaction inflammatoire se traduisant quelquefois par des granulocytes dans les selles. Lors d’infection à EHEC, les patients n’ont habituellement pas de fièvre.
Tableau 2 : Les six pathovars d’E. coli responsables de diarrhées chez l’homme
DIARRHÉES POST-ANTIBIOTIQUES
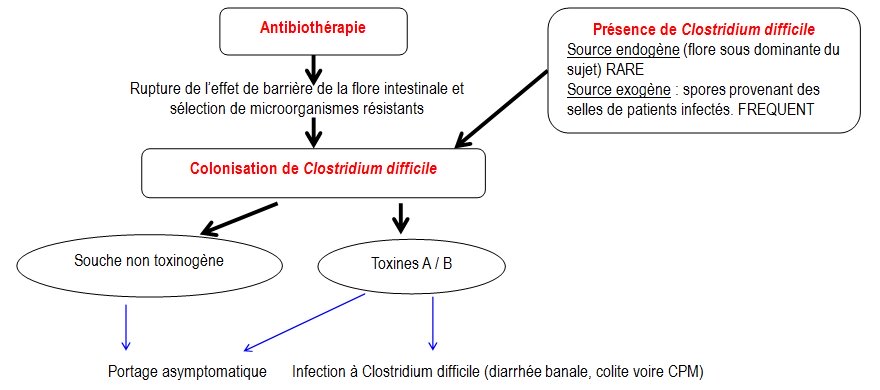
Les diarrhées sont quelquefois consécutives à un traitement antibiotique. Dans ce cas, une partie de la flore commensale intestinale est détruite, il reste alors de la place pour :
- l’implantation de microorganismes exogènes (comme Clostridium difficile)
- la pullulation de microorganismes commensaux résistants à l’antibiotique, maintenus jusqu’alors à l’état sous-dominant par l’effet de barrière des autres bactéries commensales. Ces microorganismes, sélectionnés par le traitement antibiotique, peuvent alors se multiplier sans entrave et entraîner une diarrhée. C’est le cas de Klebsiella oxytoca, Clostridium perfringens, Staphylococcus aureus, de levures (Candida spp), et de Clostridium difficile.
Remarque : cette pullulation intestinale favorise les échanges génétiques entre bactéries (transfert de plasmides, transposons) en particulier le transfert horizontal de gènes de résistance. Elle participe alors à l’émergence de bactéries multi-résistantes.
CLOSTRIDIUM DIFFICILE est le microorganisme le plus fréquemment responsable de diarrhées post-antibiotiques
Épidémiologie
Les diarrhées post-antibiotiques à Clostridium difficile représentent 15 à 25 % des diarrhées acquises à l’hôpital chez l’adulte et vont de la simple diarrhée à la colite pseudomembraneuse (CPM) beaucoup plus sévère.
Clostridium difficile est un bacille gram positif anaérobie strict très répandu dans l’environnement où il survit sous forme sporulée. Chez l’adulte sain le portage asymptomatique est rare (< 3%) mais augmente avec la durée d’hospitalisation (10 à 25 %). Chez les nourrissons, ce portage est très fréquent (50 à 70 %). La prolifération dans l’intestin est toujours liée à une antibiothérapie (presque tous les antibiotiques ont été mis en cause mais la clindamycine, l’ampicilline, l’amoxicilline, les céphalosporines de 3ème génération et récemment les fluoroquinolones sont les antibiotiques les plus à risque car ils ont une activité sur les bactéries anaérobies de la flore de barrière). Seules les souches toxinogènes capables de produire la toxine A et/ou B sont pathogènes. Les deux toxines sont habituellement produites simultanément mais de rares souches ne produisent que la toxine B.
- La toxine A est une entérotoxine
- La toxine B est une cytotoxine
Physiopathologie
Après fixation sur leurs récepteurs spécifiques, les toxines pénètrent dans les entérocytes par endocytose et agissent en synergie en détruisant les jonctions serrées reliant les entérocytes (dépolymérisation des filaments d’actine du cytosquelette), ce qui conduit à une augmentation de la perméabilité paracellulaire de la muqueuse colique et à une réaction inflammatoire intense à l’origine de la formation de pseudomembranes.
Fig. 12 : Physiopathologie des infections à Clostridium difficile (ICD)
Manifestations cliniques et diagnostic
La CPM est une diarrhée profuse avec fièvre, douleurs abdominales et inflammation du colon. Les complications peuvent être graves (mégacolon toxique, perforation intestinale, décès) ce qui rend le diagnostic URGENT. La mise en évidence, par endoscopie, de pseudomembranes (constituées de mucus, fibrine, débris cellulaires et leucocytes) permet de poser le diagnostic de CPM mais ces fausses membranes n’étant pas toujours présentes en début de maladie, le diagnostic biologique reste primordial. Il consiste à rechercher au moins une toxine de Clostridium difficile directement dans les selles ou sur la souche isolée.
Traitement et isolement septique
Après arrêt de la prise d’antibiotique inducteur et dans le cas de symptômes sévères, les sujets sont traités avec du métronidazole ou de la vancomycine. La prévention repose sur l’isolement des malades au moins pendant l’épisode diarrhéique et la mise en place de précautions d’hygiène particulières (ports de gants et de surblouses pour le personnel, désinfection de l’environnement par un aldéhyde ou de l’hypochlorite). On parle d’isolement septique.
DIARRHÉES VIRALES
Plus de la moitié des diarrhées infectieuses sont virales. La gastroentérite aiguë atteint surtout des enfants de moins de 2 ans, avec un pic maximum entre 6 et 12 mois. Différents virus sont en cause, et parmi eux les rotavirus et les norovirus dans 60 % des cas, mais aussi d’autres virus (astrovirus, adénovirus…).
Les diarrhées virales se traduisent par des nausées, des vomissements, des douleurs abdominales et des diarrhées hydriques, il n’y a pas de granulocytes neutrophiles dans les selles. Chez les enfants et les personnes âgés l’infection peut être sévère mais la plupart du temps, en moins d’une semaine, les symptômes disparaissent.
Les Rotavirus sont responsables des gastroentérites aiguës (GEA) sévères du nourrisson et de l’enfant de moins de 5 ans partout dans le monde ; ils représentent la principale cause de mortalité infantile dans les pays en voie de développement. En France, ces infections entrainent peu de décès mais sont la cause la plus fréquente de consultation pédiatrique et la deuxième cause d’hospitalisation.
Les Norovirus sont les principaux agents de gastro-entérites virales aigües chez l’homme, toutes classes d’âge confondues. Ils provoquent des épidémies de sévérité modérée d’origine hydriques ou alimentaire au sein des collectivités. Ces gastro-entérites sont caractérisées par l’apparition brutale de vomissements et/ou de diarrhée après une courte incubation de 24 à 48 heures. La majorité des infections guérissent spontanément en quelques jours.
Les Astrovirus et les Adénovirus restent minoritaires, sauf immunodépression sous-jacente.
DIARRHÉES PARASITAIRES
Les diarrhées dues à des parasitoses sont le plus souvent observées après un voyage en zone tropicale. En Europe, certains parasites autochtones peuvent également provoquer des TIA.
Les parasites en cause sont différents selon le type de diarrhée :
| Parasitoses | |
Diarrhées aiguës fébriles |
Le paludisme (primo-invasion) ou la trichinellose peuvent occasionner des épisodes diarrhéiques |
Diarrhées aiguës non fébriles |
La dysenterie amibienne ou amibiase intestinale est due à une amibe pathogène : Entamoeba histolytica. Ce protozoaire tropical entraîne des diarrhées pouvant être glairo-sanglantes sans fièvre.
La contamination est essentiellement due à l’ingestion d’eau ou de crudités souillés par des matières fécales contenant des kystes. Dans le tube digestif, les kystes se transforment en trophozoïtes qui adhèrent à la muqueuse colique et détruisent les cellules en formant des pores dans leur membrane. Ils sécrètent des enzymes protéolytiques ce qui favorise leur dissémination dans la muqueuse et la sous-muqueuse colique entraînant des ulcérations, et parfois des perforations intestinales. Cette invasion peut se poursuivre par une dissémination dans le sang conduisant à des abcès hépatiques. C’est la principale cause de diarrhées parasitaires aiguës. La prévalence de l’infection atteint 10 % dans les régions intertropicales et la mortalité est estimée entre 40 000 et 100 000 personnes par an. En France, la dysenterie amibienne ne concerne que les migrants et les touristes en provenance de zones d’endémie. |
| Schistosoma mansoni, S. intercalatum et S. japonicum, agents de la bilharziose intestinale peuvent occasionner des diarrhées glairo-sanglantes. | |
Diarrhées chroniques1 |
Giardia intestinalis
Ce protozoaire intestinal cosmopolite est fréquemment trouvé en France particulièrement chez les enfants et dans les collectivités. Sa transmission est facile par les mains sales. L’homme se contamine en ingérant de l’eau ou des aliments souillés par les kystes parasitaires |
| Cryptosporidium, Microsporidium et Isospora
Ce sont des protozoaires cosmopolites opportunistes responsables de diarrhées chez des patients immunodéprimés (SIDA, greffés …) |
|
| Certains helminthes sont responsables de troubles intestinaux diffus accompagnés quelquefois de diarrhées (trichocéphales, anguillules)
Une hyperéosinophilie à l’hémogramme permettra de les suspecter. |
1 chroniques car elles persistent plus de 14 jours ; elles sont aussi non fébriles.
TABLEAUX DE SYNTHÈSE DES PRINCIPAUX MICROORGANISMES RESPONSABLES DE DIARRHÉES
Tableau 3 : Classification des bactéries responsables de diarrhées en fonction des mécanismes physiopathologiques
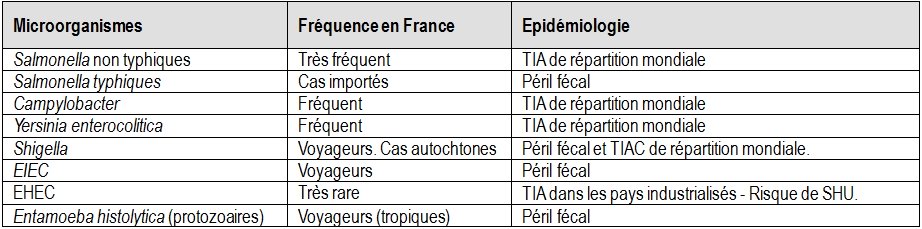
Tableau 4 : Les principaux microorganismes responsables de diarrhées inflammatoires
Rappel : les bactéries responsables de diarrhées inflammatoires sont entéro-invasives
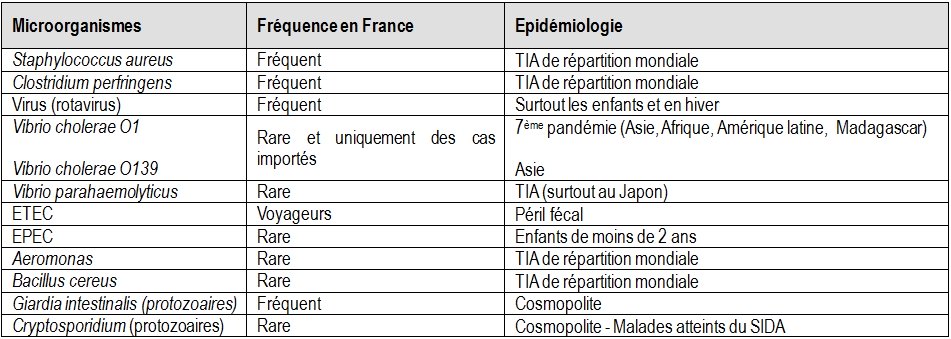
Tableaux 5 : Les principaux microorganismes responsables de diarrhées hydriques
Rappel : les bactéries responsables de diarrhées hydriques ne franchissent pas l’épithélium intestinal et sont essentiellement entérotoxiques