ECBU
| Aspect de l’urine | Trouble |
| Cytologie en cellule de Kova® slide |
En moyenne 8 leucocytes par petit carré d’une lame Kova® slide
Quelques hématies, assez nombreuses cellules probablement tubulaires. Nombreux cylindres leucocytaires et granuleux. Absence de cristaux. |
| Gram sur le culot de centrifugation | Quelques bacilles à Gram négatif |
| Uriselect 4 | Ensemencée avec la technique à l’anse calibrée de 10 µL.
|
Questions
| Pour faire apparaitre la réponse, cliquez sur la question ! |
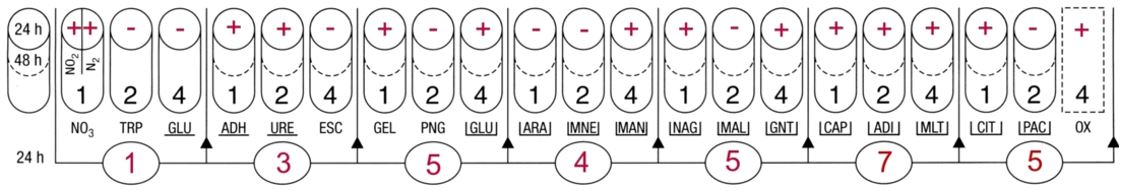
Sur les colonies roses : un test indole
Sur les colonies incolores : un Gram et un test enzymatique d’orientation.
Les résultats obtenus sont les suivants :
| colonies roses | indole + |
| colonies incolores | bacilles à Gram négatifs, fins, droits et aux extrémités arrondies – oxydase + |
| Liens utiles |
| Fiche technique de la gélose Uriselect4 |
Les colonies roses sont des bacilles Gram négatif ß galactosidase + ß glucosidase -. Ces résultats orientent vers E. coli. Avec un test indole +, on identifie E.coli.
Les colonies blanches sont des bacilles Gram négatif ß galactosidase –, ß glucosidase – et oxydase + : orientation vers Pseudomonas et genres apparentés. On peut poursuivre l’identification avec une galerie Api 20NE associée à un contrôle de pureté.
Comme on a compté dans 1 petit carré, il faut multiplier le résultat obtenu par 90 pour obtenir la leucocyturie en leucocytes/µL soit 8 x 90 = 720 leucocytes/µL et donc 7,2.105 leucocytes/mL
Cependant, comme la patiente porte une sonde urinaire, ce paramètre n’est pas exploitable.
La présence de cellules probablement tubulaires mais surtout celle de cylindres granuleux et leucocytaires oriente vers une infection haute = pyélonéphrite.
| Liens utiles |
| Cellule de Malassez |
| Lecture du contrôle de pureté = un seul type de colonie
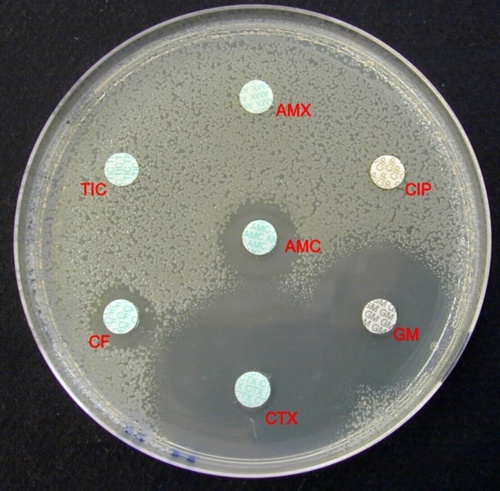
TIC = Ticarcilline – CAZ = Ceftazidime – IPM = Imipenem – GM = Gentamicine – CIP = Cirpofloxacine – CS = colistine |
On observe un seule type de colonie sur le contrôle de pureté, la suspension utilisée pour ensemencer la galerie n’a pas été contaminée.
| Document utile |

|
La galerie API 20NE présente un profil caractéristique de Pseudomonas aeruginosa.
| Liens utiles |
| Identifieur « api » d’UPBM le Lab (un grand merci à Antoine Gaudin et Jean-Noël Joffin !) |
Escherichia coli fait partie du groupe 1 des germes urinaires et Pseudomonas aeruginosa du groupe 2.
Chez un porteur de sonde urinaire, les seuils de bactériurie sont les mêmes quel que soit le groupe d’uropathogénicité. Ici la patiente présente des symptômes, le seuil de 105 UFC/mL, est atteint pour ces deux germes, on peut conclure à une infection bimicrobienne sur sonde urinaire. La présence de cylindres granuleux et leucocytaires indiquent que l’infection affecte les reins. C’est une pyélonéphrite. (tableau B ligne 1).
| Liens utiles |
| Abaque de lecture du dénombrement des germes urinaires |
Comme nous l’avons vu précédemment cette souche est un Pseudomonas aeruginosa. Cette espèce ne présente pas de résistance naturelle aux antibiotiques testés.
| Liens utiles |
| CASFM-EUCAST 2019 |
La souche de Pseudomonas aeruginosa n’a pas acquis de résistance aux antibiotiques testés.
Attention en mesurant le diamètre d’inhibition autour du disque de ceftazidime.
On note un antagonisme entre ces deux antibiotiques. En effet l’imipenem est un fort inducteur de la synthèse de la céphalosporinase naturelle. Ainsi en présence d’imipenem, la souche sécrète davantage de céphalosporinase. Par conséquence, entre les deux disques, la ceftazidime diffuse moins loin que de l’autre côté car elle est hydrolysée par la céphalosporinase. La bordure de la zone d’inhibition est ainsi plus proche du disque de ceftazidime en présence d’imipenem.
Cet antagonisme rend difficile la mesure du diamètre d’inhibition autour de la ceftazidime : il faut mesurer un rayon d’inhibition en partant du centre du disque jusqu’au bord de la zone d’inhibition dans la direction opposé au disque d’imipenem puis le multiplier par 2.
La photo ci-dessous, prise sur une autre boite, montre comment mesurer ce rayon.
| Lecture du contrôle de pureté = un seul type de colonie
AMX = Amoxicilline – TIC = Ticarcilline – CF = Céfalotine – CTX = Céfotaxime- GM = Gentamicine – CIP = Cirpofloxacine – AMC = Amoxicilline + acide clavulanique |
Le disque d’AMC contient de l’acide clavulanique, un inhibiteur de pénicillinase. La zone d’inhibition autour du disque d’AMC montre que l’acide clavulanique a restauré partiellement l’activité de l’amoxicilline. Cette souche sécrète donc une enzyme hydrolysant les pénicillines qui est inhibée par l’acide clavulanique. Le diamètre autour du disque d’amoxicilline + acide clavulanique est comprise entre les deux diamètres critiques. La souche présente donc une résistance intermédiaire à cette association.
Comme vu précédemment cette souche est un Escherichia coli. Cette espèce est naturellement sensible aux antibiotiques testés ici
| Liens utiles |
| CASFM-EUCAST 2019 |
Cette souche résiste à l’amoxicilline, la ticarcilline, la céfalotine et l’association amoxicilline + acide clavulanique (résistance intermédiaire pour cette dernière). Ce sont donc des résistances acquises. Comme elle demeure sensible au céfotaxime, elle n’a pas acquis de BLSE.
Ce ne peut être le phénotype céphalosporinase bas niveau car elle serait sensible à la ticarcilline.
Ce ne peut pas être le phénotype céphalosporinase haut niveau car elle serait résistante au céfotaxime.
Ni le phénotype pénicillinase bas niveau car elle serait sensible à la céfalotine et à l’association amoxicilline + acide clavulanique.
Ce ne peut pas être le phénotype pénicillinase TRI car elle serait sensible à la céfalotine.
C’est ici le phénotype pénicillinase haut niveau. Le niveau de sécrétion de cette pénicillinase est suffisant pour rendre la bactérie résistante à la céfalotine et à l’association amoxicilline + acide clavulanique.
| FIN DE L’ÉTUDE DE CAS |

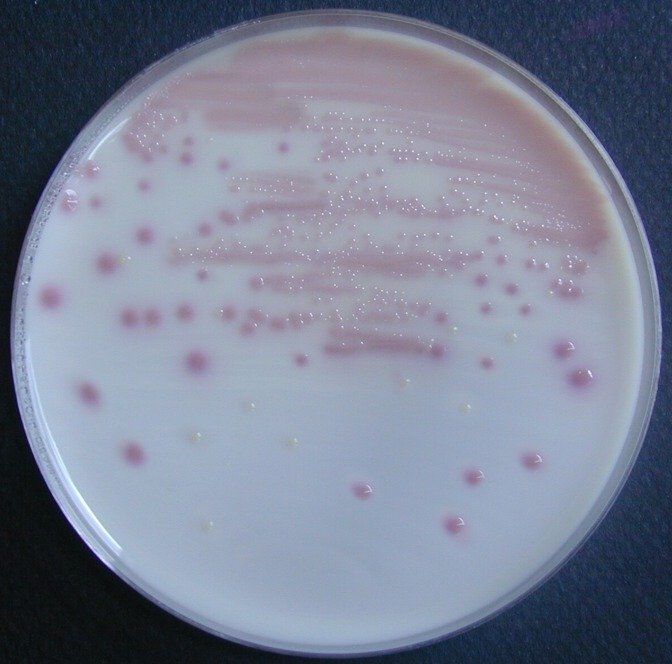 Regardez bien il y a deux types de colonies !
Regardez bien il y a deux types de colonies !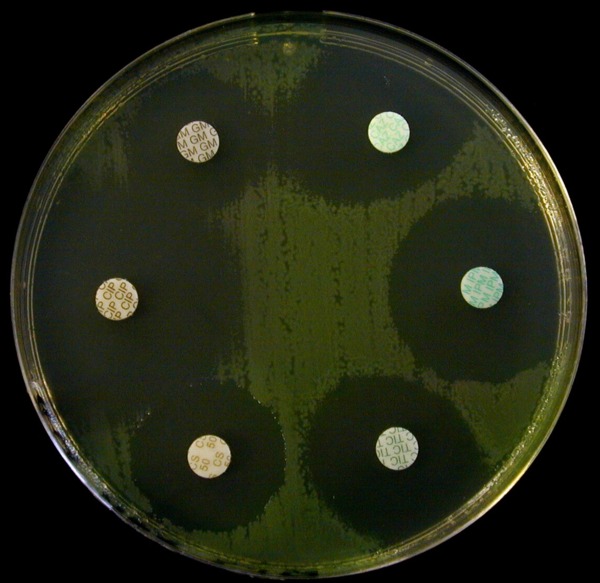 Antibiogramme des colonies incolores
Antibiogramme des colonies incolores