Trois méthodes de dénombrement des germes urinaires sont présentés ici :
MÉTHODE DE L’ANSE CALIBRÉE
Présentation
Cette méthode est la méthode manuelle actuellement la plus utilisée : dénombrement des germes urinaires et isolement sont simultanés.
Elle nécessite un milieu non sélectif coulé en boite de Petri et une anse calibrée de 10 µL. Plusieurs milieux peuvent être utilisés allant de milieux classiques type BCP ou CLED à des milieux chromogènes plus performants (CPS3, URISELECT4….). Ces derniers ont comme avantage de permettre une orientation rapide voire une identification directe des bactéries les plus fréquemment isolées dans les infections urinaires, c’est un gain de temps.
- E. coli,
- Enterococcus,
- PPM : Proteus, Providencia, Morganella,
- KESC : Klebsiella, Enterobacter, Serratia, Citrobacter.
Ensemencement
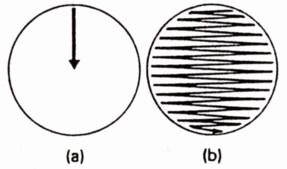
- Déposer 10 µL d’urine bien homogénéisée sur un rayon de la boite à l’aide d’une anse calibrée stérile (a).
- Étaler le dépôt en stries perpendiculaires au rayon sur toute la surface de la gélose (b).
- Incuber 18 à 24 heures à 37°C.
* si le prélèvement a été recueilli par ponction vésicale, on ensemence 100 µL d’urine
Lecture
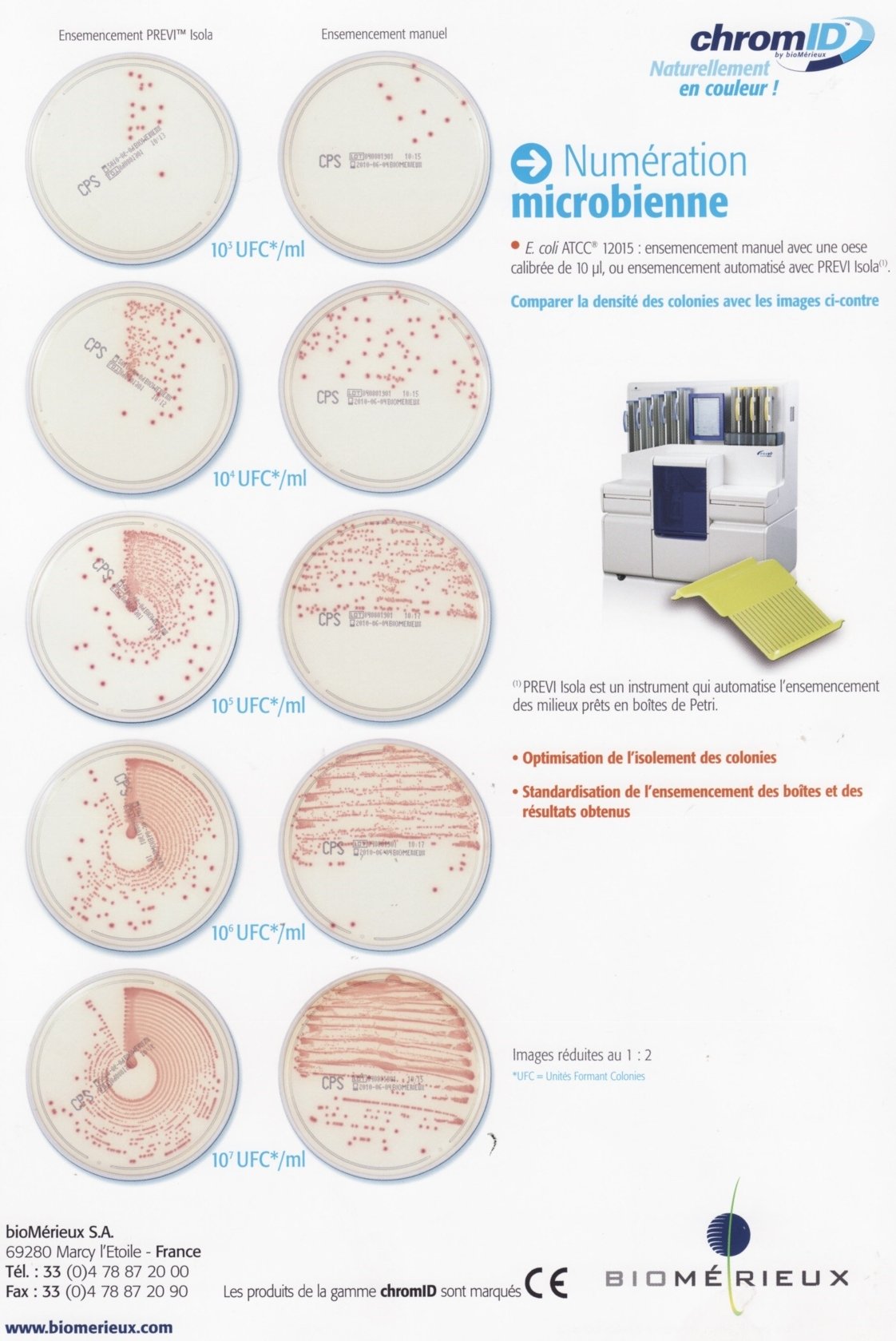
Le DGU repose sur une comparaison de la densité des colonies présentes sur la partie supérieure de la gélose à celle du schéma fourni avec la fiche technique.
Rendre le résultat en nombre UFC / mL d’urine.
Planches étalons
MÉTHODE DE LA LAME IMMERGÉE
(Exemples : Système URILINE bioMérieux, DGU BioRad, URICULT® FUMOUZE)
Présentation
Ces systèmes sont constitués d’une lame de plastique recouverte de 2 milieux de culture gélosés permettant de déterminer la bactériurie après avoir été plongée dans l’urine fraîchement émise.
La lame, protégée par un tube étanche en plastique transparent, est recouverte par un milieu différent sur chaque face.
Face 1: milieu CLED (Cystine Lactose Electrolyte Déficient ; coloration verte).
Peptone – Extrait de viande – Extrait de levure -Cystine – Lactose – Bleu de bromothymol- pH : 6,9-7,4
Ce milieu non sélectif permet la détermination du nombre total de bactéries présentes dans l’urine. Il permet également de différencier les germes fermentant le lactose des germes non fermentatifs. Sa faible teneur en électrolytes a pour objectif de limiter l’envahissement de la surface du milieu par les Proteus. Néanmoins les cultures de Proteus réussissent à envahir la surface de ce milieu et empêchent leur dénombrement.
Face 2 : milieu Mac Conkey (couleur brun rouge)
Peptone -Lactose – Sels biliaires – Rouge neutre pH 7,1
Ce milieu sélectif inhibe la croissance de la plupart des bactéries Gram positif grâce à la présence des sels biliaires (les Enterococcus cultivent sur ce milieu).Il concourt également à la différenciation des germes présents par la présence de lactose et de rouge neutre.
Il permet le dénombrement des Proteus car les cultures ne sont pas ici envahissantes.
Utilisation
- Saisir la lame par l’intermédiaire du bouchon auquel elle est fixée,
- Immerger complètement les deux faces,
- Retirer immédiatement, laisser égoutter l’excès
- Replacer soigneusement la lame dans le tube, puis revisser le bouchon hermétiquement.
- Compléter l’étiquette : nom, date de naissance, date, heure.
Incuber 18‑24 heures à 37°C en position verticale.
© Pascal Fraperie
Détermination de la bactériurie
Retirer la lame du tube.
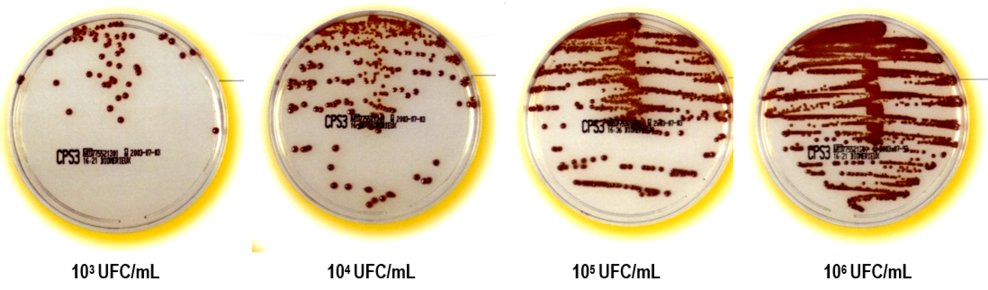
La lecture se fait sur la gélose CLED (et non sur le milieu Mac Conkey en raison de son caractère sélectif) en comparant la densité des colonies avec une série de reproductions étalons correspondant à : 103, 104, 105, 106, 107 UFC/mL d’urine.
Il est important d’observer très attentivement la surface des milieux qui peuvent être recouverts de colonies confluentes donnant un voile homogène, difficile à détecter.

Orientation de l’identification
La couleur des colonies obtenues et la capacité à cultiver sur le milieu Mac Conkey (milieu pauvre qui inhibe une grande partie de la flore à Gram positif) permettent de déterminer le caractère lactose et de faire un pronostic sur le résultat du Gram (attention les Enterococcus cultive sur le milieu Mac Conkey)
| Lactose (+) | Lactose (-) | |
| Gélose CLED | colonies jaunes | colonies vertes, bleues ou incolores |
| Gélose Mac Conkey | colonies rouges | colonies incolores ou faiblement colorées à beiges |