Ce diagnostic est particulièrement intéressant pour dépister les tuberculoses latentes ou actives (peu symptomatiques)
Le test tuberculinique ou intradermo-réaction à la tuberculine (IDR)
L’intradermoréaction (IDR) à la tuberculine met en évidence la présence d’une hypersensibilité retardée induite par les antigènes mycobactériens (Mycobacterium tuberculosis, BCG, certaines mycobactéries atypiques)
Elle consiste en l’injection intradermique de tuberculine PPD (dérivé protéinique purifié). La lecture se fait quarante-huit à soixante-douze heures plus tard, par la mesure du diamètre de l’induration en millimètres (Fig. 1).
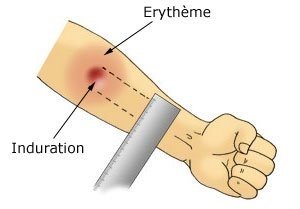 Figure 1 : mesure du diamètre de l’induration
Figure 1 : mesure du diamètre de l’induration
http://www.respir.com
Autrefois utilisée pour attester de l’efficacité de la vaccination, l’IDR sert désormais seulement à des fins de diagnostic et de surveillance, elle est pratiquée :
1° Pour vérifier l’absence de tuberculose infection ou de tuberculose maladie avant la primovaccination. Toutefois, les nouveau-nés sont vaccinés sans test préalable ;
2° Dans l’enquête autour d’un cas de tuberculose ;
3° Comme aide au diagnostic de la tuberculose ;
4° Comme test de référence dans le cadre de la surveillance des membres des professions énumérées aux articles R. 3112-1 et R. 3112-2 du code de la santé publique.
Le seuil de positivité est de 5 millimètres ; en dessous de 5 millimètres, l’intradermoréaction est considérée comme négative.
Toute positivation de l’IDR ou toute augmentation d’au moins 10 millimètres du diamètre de l’induration par rapport à une IDR antérieure impose des investigations complémentaires à la recherche d’une primo-infection tuberculeuse ou d’une tuberculose maladie.
L’IDR à la tuberculine (IDR) présente plusieurs limites (réalisation, lecture et interprétation, …), dont la principale est certainement son manque de spécificité à l’égard du vaccin par le bacille de Calmette et Guérin (BCG) : positivité de l’IDR si vaccination par le BCG.
L’IDR post vaccinale n’est plus pratiquée.
Tests de sécrétion d’interféron γ (IGRA : interferon gamma release assay)
La réponse immunitaire à l’infection par des mycobactéries tuberculeuses est principalement une réponse immunitaire à médiation cellulaire au cours de laquelle des lymphocytes T sont sensibilisés aux antigènes de ces mycobactéries. Lorsque ces lymphocytes T rencontrent de nouveau ces antigènes, ils réagissent en libérant des cytokines comme l’interféron gamma (IFNγ).
Deux tests, QuantiFERON-TB® (Cellestis) et le T-SPOT.TB® (Oxford Immunotec), permettent de mettre en évidence la réponse immunitaire protectrice à l’égard de M. tuberculosis en recherchant les lymphocytes sensibilisés par une mycobactérie tuberculeuse.
Pour cela, des peptides présents chez les mycobactéries tuberculeuses (sauf le BCG) sont introduits dans un échantillon de sang. Après une incubation d’une nuit à 37°C et dans le cas d’une tuberculose latente ou active, les lymphocytes sanguins sensibilisés libèrent de l’IFNγ. Ce dernier est ensuite détecté par méthode ELISA (test QuantiFERON-TB®) ou par méthode ELISPOT (test T-SPOT.TB®).
Un témoin négatif (sans peptide stimulant) et un témoin positif (avec un agent mitogène provoquant la sécrétion d’IFNγ) sont réalisés en parallèle.
Ces tests sont beaucoup plus spécifiques que l’IDR et présentent l’avantage de rester négatifs après vaccination par le BCG.
Il existe cependant une réactivité croisée avec trois espèces de mycobactéries non tuberculeuses possédant les antigènes ESAT6 et CFP-10 : M. marinum, M. szulgai and M. kansasii.
Test QuantiFERON-TB®
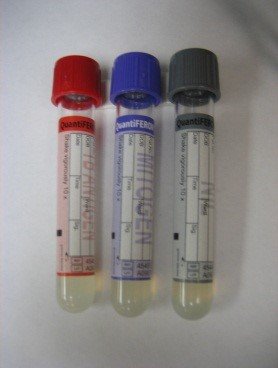
Prélèvement de sang total dans 3 tubes (Fig. 2) :
- un tube contrôle sans stimulant
- un tube test contenant les 3 peptides : ESAT6, CFP-10, TB7.7
- et un tube témoin positif contenant un mitogène PHA
Homogénéisation en retournant plusieurs fois les tubes.
Incubation des tubes debout 16 à 24 heures à 37°C.
Centrifugation 15 min entre 2000 et 3000g
Dosage de l’IFNγ par méthode ELISA
Le plasma peut être conservé au congélateur si le dosage de l’IFNγ n’est pas immédiat.
Test T-SPOT.TB®
Ce test, version simplifiée de la technique ELISPOT, est d’une sensibilité exceptionnelle dans la mesure où l’IFNγ est capturé directement autour de la cellule sécrétrice, avant qu’il ne soit dilué dans le surnageant, capturé par les récepteurs de cellules adjacentes ou encore dégradé. Il est recommandé pour un dépistage chez les immunodéprimés.
Pour ce test, le sang doit être recueilli sur anticoagulant (citrate de sodium ou héparine-lithium).
Préparation de la suspension de cellules mononuclées (PBMC)
Les cellules mononuclées de sang périphérique (PBMC) sont séparées de l’échantillon de sang total et lavées pour éliminer toutes les sources de bruit de fond. Les PBMC sont ensuite comptées de sorte qu’un nombre standardisé de cellules soit utilisé.
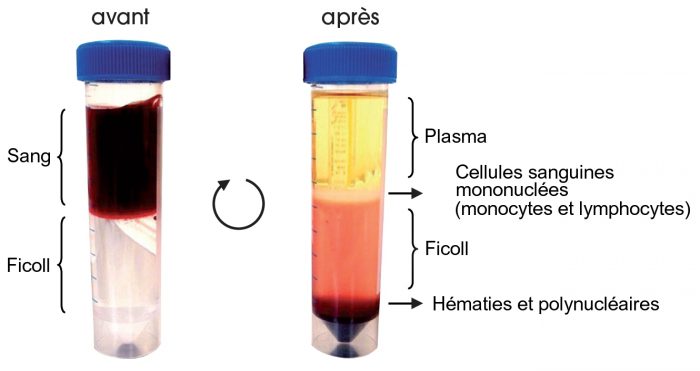
1. Isolement des cellules mononuclées du sang (Fig. 3)
Comme les cellules mononuclées sanguines sont moins denses que les érythrocytes et les polynucléaires, il est possible de les séparer par centrifugation en gradient de densité de Ficoll® :
-
les hématies et les polynucléaires, plus denses que le Ficoll), passent à travers et sédimentent au fond du tube ;
-
les lymphocytes et les monocytes, moins denses que le Ficoll, restent à l’interface du plasma et du Ficoll.
Juste après la centrifugation, les cellules mononuclées doivent être délicatement prélevées (sans aspirer de Ficoll) et transvasées dans un tube conique stérile
2. Lavage des cellules mononuclées
Laver les cellules deux fois dans le sérum AIM-V commercialisé par GIBCO™.
3. Dénombrement des cellules mononuclées viables en présence de bleu Trypan en hématimètre.
Le bleu Trypan ne pénètre pas dans les cellules viables, seules les cellules mortes apparaissent colorées en bleu.
4. Préparer une suspension à 2,5. 106 cellules viables par mL.
Dépôts de la suspension sur une plaque dont les puits sont tapissés d’anticorps anti IFNγ
Quatre puits (Fig.4) sont nécessaires pour chaque prélèvement :
| Puits 1 | seulement du milieu (contrôle négatif) pour identifier l’activation cellulaire non-spécifique |
| Puits 2 | milieu contenant l’antigène ESAT6 |
| Puits 3 | milieu contenant l’antigène CFP-10 |
| Puits 4 | milieu contenant de la phytohémagglutinine (PHA, un activateur ployclonal connu) pour confirmer la fonctionnalité des PBMC (contrôle positif) |
Déposer 100 µL de la suspension dans chacun des puits.
Incubation
Laisser incuber pendant 18h à 37°c sous atmosphère enrichie en CO2.
Lors de cette incubation, les cellules T sensibilisées éventuellement présentes sécrètent de l’IFNγ qui sera capturé par les anticorps spécifiques présents dans les puits.
Lavage des puits
- Vider les puits en retournant la plaque au-dessus d’un container.
- Laver les puits en ajoutant 200 µL de tampon PBS.
- Vider les puits en retournant la plaque au-dessus d’un container.
- Faire 3 autres lavages en tampon PBS.
- Bien vider les puits après le quatrième lavage en retournant la plaque et en la tapotant posée sur du papier absorbant.
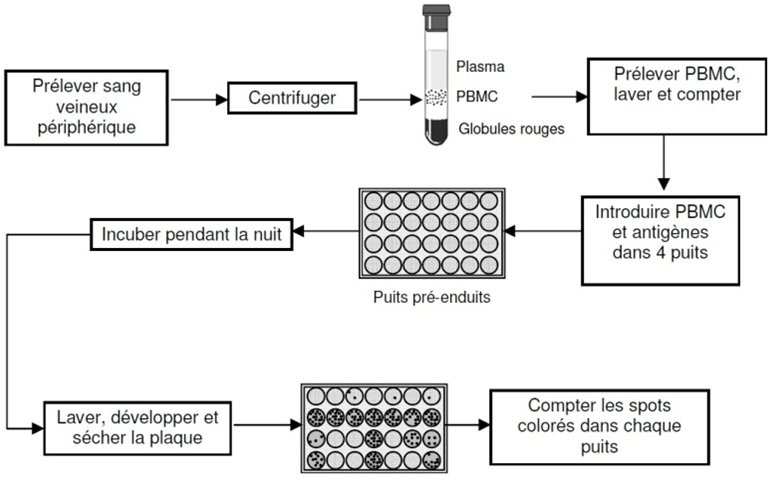
Schéma extrait de la notice http://www.oxfordimmunotec.com/96-France
Révélation des cellules productrices d’IFNγ
Un second anticorps, conjugué à la phosphatase alcaline et dirigé sur un autre épitope de l’IFNγ, est ajouté et se fixe sur la cytokine capturée à la surface de la membrane. Tout conjugué non fixé est éliminé par lavage. Un substrat soluble est ajouté dans chaque puits ; il est clivé par l’enzyme qui lui est liée et forme ainsi un spot de précipité insoluble au site de la réaction. Chaque spot représente l’empreinte d’une cellule T individuelle sécrétrice de cytokines et le comptage des spots obtenus donne une mesure de la quantité de cellules T effectrices sensibles à M. tuberculosis dans le sang périphérique.
- Introduire 50 μL de solution de travail du réactif conjugué dans chaque puits et incuber à 2 à 8°C pendant 1 heure.
- Éliminer le conjugué et effectuer quatre lavages au PBS comme décrit aux étapes 2 et 3 ci-dessus.
- Introduire 50 μL de solution de substrat dans chaque puits et incuber à température ambiante pendant 7 min.
- Laver la plaque abondamment avec de l’eau distillée ou déionisée pour arrêter la réaction de détection.
- Laisser sécher la plaque en la mettant dans un endroit bien aéré ou dans un four à une température maximale de 37°C.
- Compter et noter le nombre de spots bleu foncé distincts sur la membrane de chaque puits (Fig. 5).
Les spots peuvent être visualisés de plusieurs façons à savoir une loupe à main, un microscope adéquat, un microscope numérique ou un lecteur de plaque ELISPOT dédié.
Fig. 5 : Lecture des boites du test T-SPOT.TB®
Source : http://www.sfls.aei.fr/diaporamas/2009/tuberculose/elispot-et-quantifron.pdf
Indications de ces tests
En France, la Haute Autorité de Santé (HAS) limite leur indication aux contextes suivants :
- pour réaliser l’enquête (diagnostic de tuberculose-infection latente) autour d’un cas, uniquement chez les adultes (de plus de 15 ans) ;
- lors de leur embauche, pour les professionnels de santé, et pour ceux travaillant dans un service à risque (listés dans les articles R. 3112-1 et R. 3112-2 du Code de la santé publique), c’est-à-dire dans les mêmes conditions que celles préconisées par les recommandations sur l’IDR ;
- pour aider au diagnostic des formes extrapulmonaires de la tuberculose-maladie souvent difficiles à étiqueter ;
- avant la mise en route d’un traitement par anti-TNFα, dans les mêmes conditions que les recommandations de l’Afssaps (Prévention et prise en charge des tuberculoses survenant sous anti-TNF, 2005).
D’autres indications potentiellement intéressantes ne sont actuellement pas retenues par l’HAS:
- suivi d’une tuberculose-infection latente traitée ou non;
- diagnostic et suivi du traitement d’une tuberculose-maladie;
- utilisation du test chez les patients infectés par le VIH;
- dépistage de la tuberculose infection latente chez les migrants en provenance de pays à prévalence élevée de tuberculose;
- utilisation du test chez l’enfant;
Aux USA, ces tests ont remplacé l’intradermoréaction (I.D.R.).
En Angleterre, ils sont recommandés si l’I.D.R est négative ou douteuse.

