Examen cytobactériologique des sécrétions bronchopulmonaires
Un homme de 75 ans présente une forte fièvre, de la toux et des difficultés respiratoires. Il est hospitalisé en urgence et, après avoir observé la radiographie des poumons, le médecin diagnostique une pneumonie. Un ECBC est prescrit.
| Aspect du crachat |
Mucopurulent |
| Gram objectif X100 |
Présence de très nombreux petits bacilles Gram – largement majoritaires |
| MGG objectif x10 | 5 cellules épithéliales pharyngées par champ
Plus de 25 granulocytes par champ quelques macrophages alvéolaires |
Questions
| Pour faire apparaitre la réponse, cliquez sur la question ! |
Le crachat est faiblement contaminé par la salive (seulement 5 cellules épithéliales pharyngées/champ).
Le nombre de granulocytes par champ est supérieur à 25 ce qui indique que le prélèvement provient probablement du foyer infectieux.
Selon la classification de Murray et Washington, c’est un crachat de classe 5 donc de très bonne qualité. Il peut être mis en culture.
| Liens utiles |
| Évaluation de la qualité du prélèvement |
| Dilution finale à 10-2 | Dilution finale à 10-4 | |
| BCP | 5 colonies lactose + | Pas de culture |
| Gélose au sang + ANC sous atmosphère enrichie en CO2 | 17 petites colonies alpha hémolytiques. | Pas de culture |
| Gélose chocolat enrichie sous atmosphère enrichie en CO2 | Non ensemencée | 150 colonies identiques plates et grisâtres = bacille à Gram négatif très polymorphe |
1 colonie obtenue après avoir déposé 100 µL du crachat dilué à 10-2 correspond à une concentration de 103 UFC/mL
1 colonie obtenue après avoir déposé 100 µL du crachat dilué à 10-4 correspond à une concentration de 105 UFC/mL
Pour ce calcul, on utilise la formule suivante : C = (n/V) x (1/dilution)
Ainsi pour n = 1 (une colonie) ; V = 100 µL soit 10-1 mL et dilution = 10-4
on trouve C = (1/10-1) x (1/10-4) = 105 UFC/mL.
Il y a 5 colonies lactose + sur la gélose BCP ensemencé avec la dilution 10-2 du crachat. La concentration de ce germe dans le crachat est donc 5. 103 UFC/mL.
La concentration dans le crachat du germe alpha hémolytique sur la gélose au sang + ANC correspond à une concentration en germe de 17. 103 UFC/mL soit 1,7. 104 UFC/mL
La concentration dans le crachat du germe présent sur la gélose chocolat enrichie est de 150.105 UFC/mL 1,5. 107 UFC/mL.
Pour attribuer un pouvoir pathogène à un germe présent dans un crachat, il faut que sa concentration dépasse le seuil de 107 UFC/mL. Cette condition est remplie seulement par le germe formant des colonies sur la gélose chocolat enrichie.
Deux raisons à cela :
- D’abord pour des problèmes de quantité. En effet, le germe ayant formé 5 colonies lactose + sur la gélose BCP ensemencées avec la dilution 10-2 du crachat est en concentration trop faible dans le crachat pour donner des colonies après une dilution 10-4 du crachat.
- Ensuite pour des raisons d’incapacité à cultiver. En effet, le germe ayant formé les 150 colonies sur la gélose chocolat n’est pas capable de cultiver sur la gélose BCP. Pourtant ces deux milieux sont tous les deux non sélectifs mais la gélose chocolat enrichie est bien plus riche que le gélose BCP. Ce germe nécessite des milieux riches pour cultiver, il est exigeant.
On retrouve ici les mêmes types de raisons que pour la question précédente :
- Le germe ayant formé 17 colonies alpha hémolytiques sur la gélose au sang + ANC ensemencées avec la dilution 10-2 du crachat sont en concentration trop faible dans le crachat pour donner des colonies après une dilution 10-4 du crachat.
- Le germe ayant formé les 150 colonies sur la gélose chocolat n’est pas capable de cultiver sur la gélose au sang + ANC. Trois hypothèses pour expliquer cela :
- la gélose au sang n’est pas suffisamment riche
- l’acide nalidixique et la colistine inhibent la culture du germe
- les deux hypothèses précédentes réunies.
Il est noté que ce germe est un bacille à Gram négatif, ce qui expliquerait l’absence de culture sur la gélose au sang + ANC.
Ce bacille à Gram négatif est exigeant car il ne cultive pas sur la gélose BCP.
Bilan : petits bacilles Gram – incapables de cultiver sur milieu ordinaire et formant des colonies plates et grisâtres sur gélose chocolat enrichie = orientation vers le genre Haemophilus.
- Gélose trypticase soja ensemencée en nappe et dépôt de 3 disques : X, V et X+V
- Ensemencement d’une galerie API NH
- Antibiogramme sur gélose MH-F
- Contrôle de pureté de la suspension sur gélose chocolat enrichie
Placer tous les milieux à 37°C en atmosphère enrichie en CO2.
|
|
La souche exige à la fois le facteur X et le facteur V. C’est très probablement une souche d’Haemophilus influenzae.
Pour éviter d’obtenir un croissant de culture à proximité du disque X, il faut écarter davantage les disques car le facteur V diffuse loin.
| Document utile |
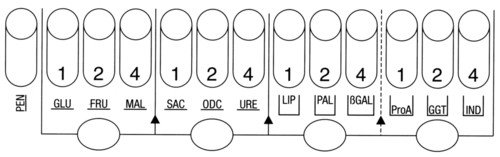 Fiche technique de la galerie API NH |
Il n’y a qu’un seul type de colonie sur la gélose chocolat enrichie, la suspension avec laquelle a été ensemencée la galerie était bien pure. La galerie API NH présente un profil caractéristique de Haemophilus influenzae. L’exploitation du tableau 1 de la fiche technique permet d’identifier le biotype 2.
| Liens utiles |
| Identifieur « api » d’UPBM le Lab (un grand merci à Antoine Gaudin et Jean-Noël Joffin !) |
Le diamètre d’inhibition autour du disque de pénicilline G est supérieur à 12 mm. Selon le CA SFM EUCAST, la souche est considérée sensible à toutes les béta-lactamines.
|
PNG 1 : pénicilline G à 1 unité AMC 3 = Amoxicilline (2µg) + acide clavulanique (1 µg) |
| Liens utiles |
| CASFM-EUCAST 2019 |
Le résultat de l’antibiogramme indique que cette souche est sensible à toutes les bêta-lactamines. Donc elle ne possède pas de pénicillinase. Ce qui est en accord avec le test PEN de l’API NH qui est négatif.
| FIN DE L’ÉTUDE DE CAS |


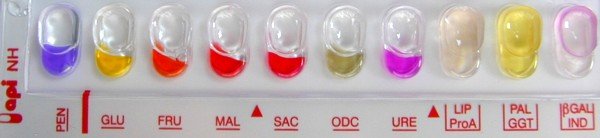 Galerie API NH après 2h d’incubation à 37°C
Galerie API NH après 2h d’incubation à 37°C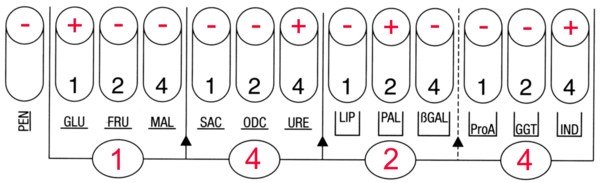
 Antibiogramme sur milieu MH-F après 24h d’incubation à 37°C en atmosphère enrichie en CO2
Antibiogramme sur milieu MH-F après 24h d’incubation à 37°C en atmosphère enrichie en CO2