Niacin test : mise en évidence de la synthèse de niacine
Toutes les mycobactéries produisent de la niacine (ou acide nicotinique), précurseur de la biosynthèse du NAD. En raison d’une voie métabolique bloquée, certaines bactéries produisent en excès et excrètent la niacine pendant leur croissance in vitro.
Le résultat est positif pour M. tuberculosis, quelquefois M. africanum et pour certaines mycobactéries non tuberculeuses (M. simiae, M. marinum, M. chelonae et M. abscessus).
Ce test, peu onéreux, est associé à la recherche de la nitrate réductase pour identifier l’espèce M. tuberculosis chez les souches appartenant au complexe tuberculosis.
Comme la niacine doit être en quantité suffisante pour être détectée, ce test est rarement réalisable sur les primocultures, il faut des subcultures (= repiquages de la primoculture).
Il se déroule en deux étapes :
- extraction de la niacine à partir d’une culture sur milieu Loewenstein Jensen
- révélation de la niacine
Extraction de la niacine
- utiliser une culture de 3 à 4 semaines ayant au moins 50 à 100 colonies ;
- ajouter 1,5 mL d’eau distillée
- racler les colonies avec une pipette sur toute la surface afin d’obtenir une suspension riche
- incliner les tubes de telle sorte que la surface du milieu soit à l’horizontale et recouverte de liquide ;
- laisser reposer les tubes dans cette position pendant 15 à 20 minutes à température ambiante ;
- transvaser avec précaution environ 0,6 mL de l’extrait dans un tube à essai muni de bouchon à vis.
Révélation de la niacine
Par la méthode de Konno, modifiée par Runyon
Principe
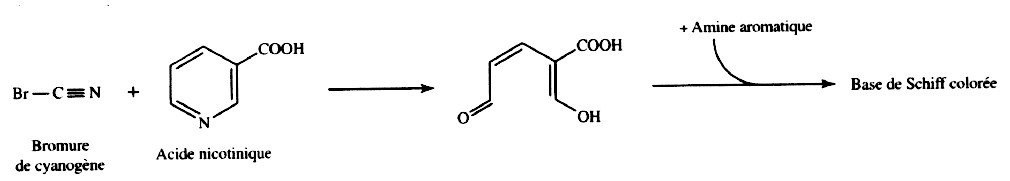
Dans un premier temps, le cycle de l’acide nicotinique est rompu au moyen du bromure de cyanogène. L’aldéhyde produit réagit ensuite avec une amine aromatique, l’aniline, pour donner, après action de la lumière, une coloration jaune.
Technique
- Ajouter 0,2 mL d’aniline à 0,6 mL d’extrait et agiter.
- Ajouter le même volume de bromure de cyanogène à 50% (attention composé toxique, travailler sous hotte)
- Agiter et laisser 15 min à la lumière
Une réaction positive se traduit par une coloration jaune
Remarque : les réactifs utilisés pour cette méthode sont toxiques.
Informations de sécurité selon le GHS (Globally Harmonized System of Classification and Labelling of Chemicals)
Par la méthode de Kilburn et Kubica
Cette technique utilise des bandelettes imprégnées de thiocyanate de potassium, de chloramine T, d’acide citrique et d’aminosalicylate de sodium.
Après avoir plongé la bandelette dans l’extrait, le thicoyanate réagit en milieu acide avec la chloramine T pour former du chlorure de cyanogène. Ce dernier donne une coloration en jaune en présence de niacine.
BBL commercialise ce type de bandelette (BBL Taxo) ainsi que des disques imprégnés de nicotinamide comme contrôle positif.
Technique du test BBL Taxo (extrait de la fiche technique)
Le test est lu comparativement à un contrôle positif et un contrôle négatif. La préparation de ces contrôles est présentée plus loin.
- À l’aide d’une paire de pinces, déposer une bandelette réactive à la niacine tuberculeuse BBL Taxo, avec la flèche orientée vers le bas, dans chaque tube (témoin positif, témoin négatif et culture testée) et boucher immédiatement.
- Agiter doucement les tubes pour mélanger le liquide avec le réactif sur le côté inférieur de la bandelette, mais ne pas incliner le tube. Renouveler l’opération 5 à 10 min plus tard.
- Après 12 à 15 min, sans dépasser 30 min, comparer la couleur des extraits.
- Autoclaver les tubes bouchés ci-dessus à l’issue du test.
Préparation des contrôles
Contrôle positif
- Introduire 0,6 mL d’eau distillée ou désionisée stérile ou de sérum physologique stérile dans un tube à essai de 13 x 75 mm.
- Ajouter un disque de témoin niacine tuberculeuse BBL Taxo, boucher et agiter doucement à trois reprises sur une période de 15 min. Laisser reposer le tube à température ambiante.
Contrôle négatif
Un témoin négatif est préparé en ajoutant 0,6 mL du même diluant à un tube à essai de 13 x 75 mm à la place de l’extrait.
La réduction des nitrates en nitrites
Principe
Les mycobactéries possédant une nitrate réductase réduisent les nitrates de sodium en nitrites après deux heures d’incubation.
Réactifs
| (1) Solutions de nitrates
NaNO3 0,850 g |
(2) Réactifs de GRIESS
Réactif I : Acide sulfanilique 0,8 g |
Protocole
Recouvrir de 2 mL de solution de nitrate une culture pure de mycobactéries sur LJ âgée de 2 semaines ou plus, puis mettre à l’étuve pendant 2 heures (37°C).
Ajouter 0,3 mL de réactif I puis 0,3 mL de réactif II.
Le test est positif s’il apparait une coloration rouge/framboise vif.

