Bactéries vaginales à haut risque infectieux (BVHRI)
Certaines bactéries de la flore vaginale commensale peuvent présenter un risque infectieux pour la femme enceinte et son fœtus. Présentes en petit nombre, au sein d’une flore vaginale dominée par la flore de Döderlein, elles ne sont pas visibles au Gram et seront repérées uniquement en culture. Il n’y a pas de pathologie vaginale, il s’agit d’un portage asymptomatique.
Les principales bactéries vaginales à haut risque infectieux (BVHRI) appartiennent aux groupes II et III de la flore commensale ; les portages les plus fréquents concernent Streptococcus agalactiae (Streptocoque du groupe B) et Escherichia coli. Moins fréquents mais entrainant plus souvent de graves complications : Haemophilus spp, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes et N. meningitidis.
Ces BVHRI peuvent, par voie ascendante, coloniser la cavité amniotique du nouveau-né suite à l’ouverture prématurée du col, à la rupture prématurée des membranes. Cette colonisation peut évoluer vers une chorioamniotite qui se manifeste par de la fièvre, des contractions utérines ; le fœtus est en souffrance. Les complications de la colonisation ou de l’infection de la cavité amniotique peuvent être :
- du côté du nouveau-né : prématurité, infection néonatale (bactériémie, méningite, infections pulmonaire ou urinaire, conjonctivite..),
- du côté de la mère : endométrite et infection pelvienne, bactériémie, stérilité.
Ces BVHRI peuvent aussi contaminer le nouveau-né lors de son passage par le vagin.
Streptococcus agalactiae (streptocoque B)
10-20% des femmes enceintes sont porteuses de Streptococcus agalactiae avec le risque de le transmettre à leur fœtus 1 fois sur 2. Les conséquences de ce portage sont rares mais graves (1 à 2 % des nouveau-nés sont susceptibles de développer une infection néonatale : bactériémie, méningite). C’est de plus le seul germe capable d’infecter le nouveau-né indépendamment de la présence de facteurs de risque infectieux. Il est responsable de 50 % des infections néonatales et de 15 % des infections de la femme enceinte.
C’est pour cela que l’HAS (Haute Autorité de Santé) recommande de rechercher entre la 34ème et la 38ème semaine d’aménorrhée Streptococcus agalactiae à partir d’un prélèvement vaginal, de le quantifier et de traiter par la pénicilline G au moment de l’accouchement toutes les porteuses.
Autres BVHRI
Les données actuelles ne permettent pas de justifier le dépistage systématique en fin de grossesse des BVHRI autres que Streptococcus agalactiae. Leur recherche se justifie s’il existe des facteurs de risque infectieux (ouverture prématurée du col, rupture prématurée des membranes, fièvre maternelle).
Source ANAES 2001 : recommandations pour la prévention anténatale du risque infectieux bactérien néonatal précoce.
Recherche du portage vaginal de Streptococcus agalactiae
Cette recherche s’effectue sur prescription explicite du clinicien : « recherche de S. agalactiae ».
Prélèvement
Écouvillonnage vaginal sur l’ensemble de la cavité vaginale en insistant sur le 1/3 inférieur du vagin (l’utilisation d’un spéculum n’est pas recommandée).
Culture
Ensemencer par quadrant une GELOSE COLUMBIA AU SANG. Incuber à 37°C sous 5 à 10% de CO2 ou en ANAEROBIOSE
Possibilité d’utiliser un milieu sélectif et spécifique de Streptococcus agalactiae (GRANADA BioMérieux) ou un milieu sélectif et chromogène (Exemples : StrepBselect BIO-RAD, chromID™ strepto B bioMérieux) voir Milieux sélectifs pour la recherche du portage de Streptococcus agalactiae
Lecture et interprétation
Les colonies suspectes sur gélose au sang sont grisâtres, translucides, de taille moyenne et présentant une discrète zone d’hémolyse ß.

© Pascal Fraperie
L’observation microscopique des colonies après coloration de Gram montre des coques à Gram positif dont le mode de groupement n’est pas toujours caractéristique. Classiquement en diplocoque ou courtes chainettes dans les prélèvements, Streptococcus agalactiae peut aussi former des amas quand le frottis est préparé avec des colonies.
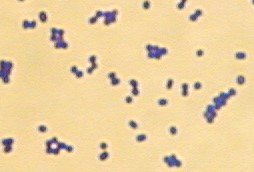
© Pascal Fraperie
Streptococcus agalactiae comme tous les Streptococcus est catalase négative. Il agglutine avec les particules de latex identifiant le groupe B.
Remarque : 50% des souches humaines de Streptococcus porcinus agglutinent aussi en B mais leurs colonies sont de petite taille et la zone d’hémolyse ß est large.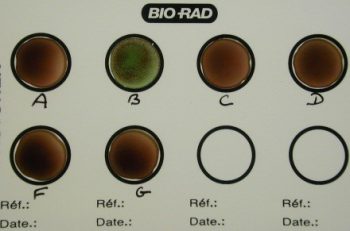
© Pascal Fraperie
La réponse (présence ou absence de S. agalactiae) est donnée de façon semi-quantitative : négative, 1+, 2+, 3+, 4+ en fonction du nombre de quadrants sur lesquels une croissance de S. agalactiae est observée. Cela permet de quantifier le risque de faible (1+) à majeur (4+). Actuellement toutes les femmes enceintes dépistées positives (1+ à 4 +) sont traitées par la pénicilline G ou le céfotaxime (en cas d’allergie à la pénicilline G).
Milieux sélectifs pour la recherche du portage de Streptococcus agalactiae
Ces milieux sont utilisés pour la détection et l’identification présomptive de Streptococcus agalactiae, communément appelés Streptocoque du Groupe B (SGB) dans les prélèvements vaginaux ou rectaux de la femme enceinte.
Leur composition en peptones et substances nutritives favorise la croissance de Streptococcus agalactiae.
Le mélange sélectif composé d’antibiotiques/antifongiques permet d’inhiber la croissance de la majorité des microorganismes.
Certains de ces milieux sont chromogènes : ils permettent la détection d’activités enzymatiques conférant une coloration caractéristique. Les enzymes recherchées sont l’alpha-glucosidase et l’estérase. Streptococcus agalactiae est alpha-glucosidase + et estérase -.
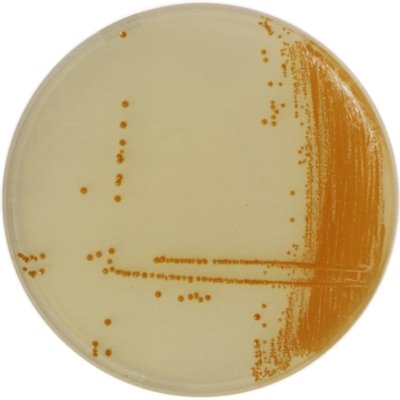
Gélose GRANADATM (bioMérieux)
COMPOSITION
- base nutritive : différentes peptones, pyruvate et glucose.
- méthotrexate, sérum de cheval et amidon permettent la production d’un pigment orange à rouge spécifique des Streptococcus agalactiae
- mélange d’antibiotiques qui inhibe la plupart des bactéries à Gram négatif et des levures
INCUBATION en ANAEROBIOSE 24h à 37°C
LECTURE
Le Streptocoque B donne des colonies orange à rouge (pigment polyénique rouge nommé granadaene).
Colonies de Streptocoque B sur gélose Granada
© bioMérieux
GRANADATM Bouillon biphasique (bioMérieux)
COMPOSITION
- Identique à celle du milieu gélosé
INCUBATION en AEROBIOSE 18h à 48h à 37°C
LECTURE (Ne pas agiter le tube avant la lecture).
• Un virage orange-rouge de faible ou forte intensité est positif.
• Si aucune coloration n’est observée, il est recommandé d’effectuer une subculture sur un milieu adapté : chromID Strepto B ou gélose + 5% sang de mouton.
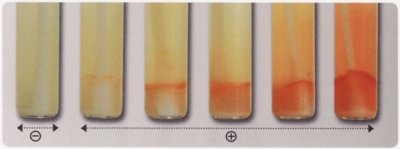
© bioMérieux
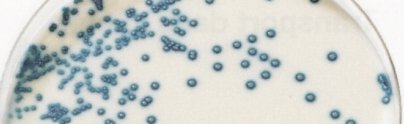
StrepBSelect TM (BIORAD)
COMPOSITION
- peptones et substances nutritives
- mélange sélectif composé d’antibiotiques/antifongiques
- des substrats chromogènes permettent la détection de l’alpha-glucosidase et de l’estérase et conférant une coloration caractéristique aux colonies de certaines espèces :
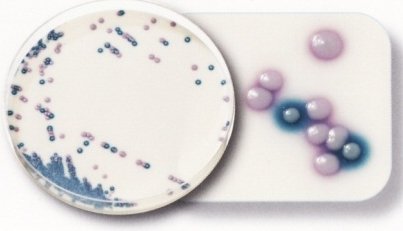
- Streptocoque B : colonies bleues
- Entérocoques : colonies de couleur rose à violet
- Lactobacilles : petites colonies de couleur rose.
INCUBATION en AEROBIOSE à l’abri de la lumière, à 35-38°C, 24 à 48h.
LECTURE
Le Streptocoque B donne des colonies bleues
Il faut poursuivre par un groupage antigénique.
Colonies de Streptocoque B
© bioMérieux
Colonies d’entérocoques et de lactobacilles
© bioMérieux
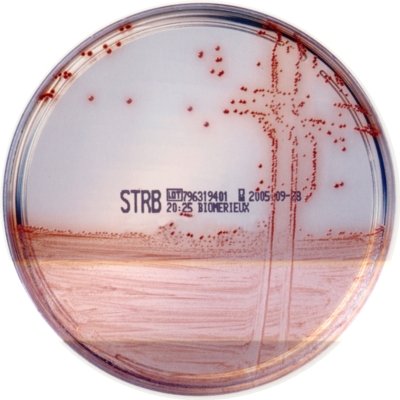
chromIDTM Strepto B (bioMérieux)
COMPOSITION
- Base nutritive associant différentes peptones,
- 3 substrats chromogènes dont deux permettrait de mettre en évidence l’alpha-glucosidase et l’estérase
- Mélange d’antibiotiques.
INCUBATION en AEROBIOSE à l’abri de la lumière, à 37°C, 18 à 48h.
LECTURE
Le streptocoque B donne des colonies allant du rose pâle au rouge.
Il faut poursuivre par un groupage antigénique.
Colonies de Streptocoque B sur gélose chromIDTM Strepto B
© bioMérieux